Lauren A Beeder1 e Mary K Samplaski2
Pubblicato su International Journal of Urology 2020
Traduzione in italiano a cura del Dott. Claudio Ajmone per GiùleManidaiBambini.org
Testo originale in inglese, disponibile a questo link
1Keck School of Medicine, and 2 Institute of Urology, University of Southern California, Los Angeles, California, USA
Abstract: I farmaci antidepressivi sono comunemente usati nei maschi in età riproduttiva per il trattamento a lungo termine della depressione, così come altri disturbi. Anche se gli antidepressivi sono noti per essere associati a effetti collaterali sessuali, i loro effetti sui parametri seminali e altri marcatori della fertilità maschile sono stati descritti meno accuratamente. La maggior parte degli studi disponibili si è concentrata sugli inibitori selettivi della ricaptazione della serotonina, che hanno dimostrato di avere un impatto negativo sulla qualità dello sperma in studi in vitro, su animali e sull’uomo. La fluoxetina, in particolare, è stata oggetto di studi multipli ed è stata associata a effetti gonadotossici, tra cui una diminuzione della concentrazione e della motilità dello sperma, un aumento della frammentazione dell’acido desossiribonucleico e una diminuzione del peso degli organi riproduttivi. Gli studi di diversi altri inibitori selettivi della ricaptazione della serotonina hanno dato risultati simili. Rassicurante, questo effetto sembra essere reversibile. I dati riguardanti gli inibitori della ricaptazione della serotonina-norepinefrina, gli inibitori della ricaptazione della norepinefrina-dopamina, gli antidepressivi triciclici, gli inibitori delle monoaminoossidasi e gli antidepressivi atipici sono scarsi, vari e contrastanti. Dato l’uso diffuso e spesso a lungo termine dei farmaci antidepressivi, c’è un chiaro bisogno di ulteriori dati relativi al loro impatto sulla qualità del seme e sulla fertilità maschile.
Parole chiave: antidepressivo, effetti, infertilità maschile, farmaci, sperma.
Introduzione
Gli antidepressivi sono una delle classi di farmaci terapeutici più comunemente usati negli Stati Uniti. Mentre la maggior parte di questi farmaci sono presi per trattare la depressione, gli antidepressivi possono anche essere presi per trattare altre condizioni, come i disturbi d’ansia. Le classi principali di questi sono SSRI, SNRI, NDRI, TCA, MAOI e antidepressivi atipici. Ognuno di questi ha meccanismi d’azione leggermente diversi, e quindi può influenzare lo sperma in modi diversi.
Secondo il National Health and Nutrition Examination Survey, l’8,6% dei maschi tra i 12 e i 18 anni negli Stati Uniti ha assunto antidepressivi tra il 2011 e il 2014.1 Il numero di persone che assumono questi farmaci è aumentato di quasi il 65% in 15 anni, dal 7,7% del 1999-2002 al 12,7% del 2011-2014. Anche se le femmine sono più propense a usare questi farmaci, i maschi hanno mostrato un aumento parallelo nel loro uso di antidepressivi. L’uso di antidepressivi aumenta con l’età, dal 3,4% tra le persone di 12-19 anni al 19,1% tra le persone di età ≥60 anni. Inoltre, questi farmaci sono tipicamente assunti a lungo termine, e tra il 2011 e il 2014, il 68,0% delle persone di età ≥12 anni che hanno assunto farmaci antidepressivi li ha presi per ≥2 anni, e il 25% li ha presi per ≥10 anni.
Ci sono informazioni limitate sulla frequenza dell’uso di antidepressivi a livello globale. L’Organizzazione per la Cooperazione e lo Sviluppo Economico ha esaminato questo aspetto in una certa misura. I paesi con i più alti tassi di uso di antidepressivi sono gli USA (110 per 1000 persone), l’Islanda (106 per 1000 persone), l’Australia (89 per 1000 persone), il Canada (86 per 1000 persone) e la Danimarca (85 per 1000 persone). I paesi con il più basso uso di antidepressivi riportato sono la Corea (13 per 1000 persone), il Cile (13 per 1000 persone), l’Estonia (18 per 1000 persone), l’Ungheria (27 per 1000 persone) e la Repubblica Slovacca (31 per 1000 persone).2 Per il Giappone in particolare, sebbene manchino grandi studi epidemiologici, si stima che fino a 6 milioni di giapponesi soffrano di depressione, simile a quella vista nei paesi occidentali.3
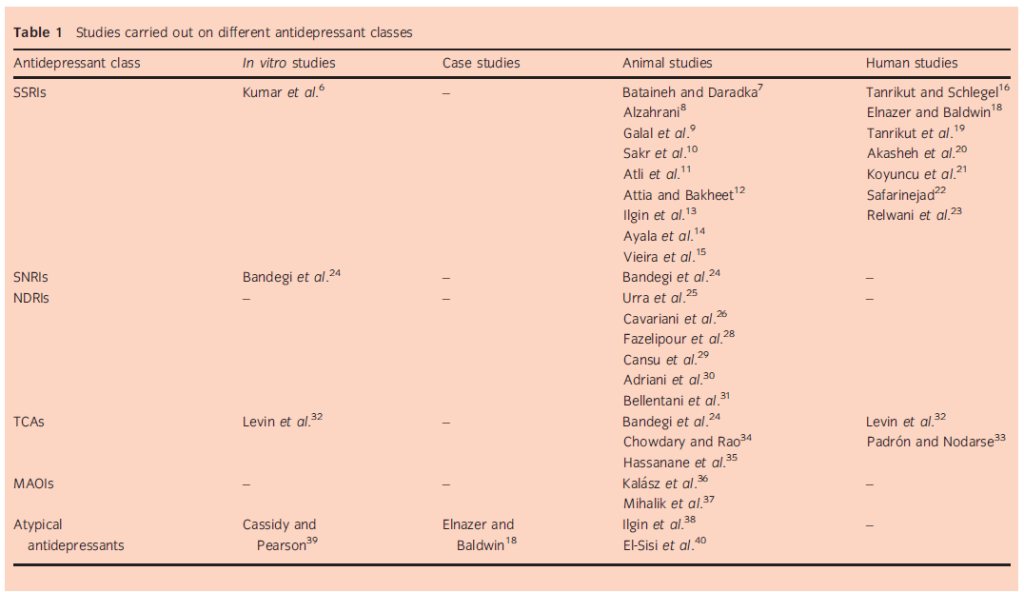
Tutte le classi di antidepressivi sono note per essere associate a qualche grado di disfunzione sessuale sia negli uomini che nelle donne. Negli uomini, gli effetti collaterali sessuali più notevoli possono includere la riduzione della libido, la disfunzione erettile, l’eiaculazione ritardata o l’aneiaculazione. Gli effetti dei farmaci antidepressivi sui parametri seminali sono stati studiati meno a fondo, anche se esistono dati per alcuni dei farmaci in ciascuna delle classi di antidepressivi. Rivediamo tutti i dati disponibili (studi in vitro, su animali e sull’uomo) riguardanti l’uso di antidepressivi sui parametri seminali e sulla fertilità maschile (Tabella 1).
SSRIs
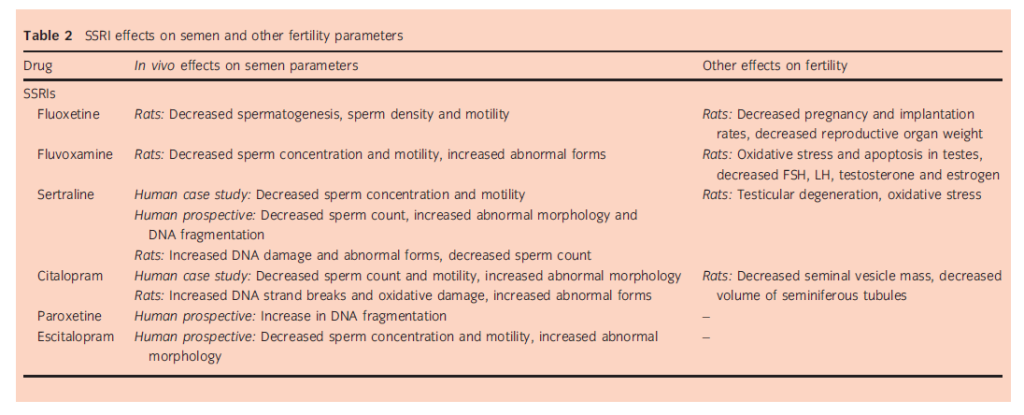
Gli SSRI agiscono inibendo la ricaptazione della serotonina e comprendono citalopram, escitalopram, fluvoxamina, paroxetina, fluoxetina e sertralina. Questi farmaci sono attualmente considerati la prima linea per il trattamento della depressione e dei disturbi d’ansia. Tuttavia, gli SSRI, in particolare, sono noti per essere associati a significativi effetti collaterali a livello sessuale, tra cui diminuzione della libido, aumento della latenza dell’eiaculazione, alterazione degli ormoni circolanti e disfunzione erettile.4,5 Gli studi stimano che il 25-73% delle persone trattate con un SSRI sperimenteranno qualche tipo di disfunzione sessuale, più alta di quella di altri antidepressivi.4 Gli studi sull’impatto di questi farmaci sulla riproduzione maschile e sui parametri seminali non sono altrettanto solidi, ma ci sono alcuni dati disponibili. Questa è la classe di antidepressivi con il maggior numero di dati disponibili per i loro effetti sui parametri seminali e sulla fertilità maschile (Tabella 2).
Studi in vitro
C’è un singolo studio in vitro che indaga sugli SSRI e lo sperma umano. Kumar et al. hanno incubato lo sperma umano con dosi variabili di paroxetina, fluoxetina, sertralina, citalopram e fluvoxamina in vitro. Tutti gli SSRI hanno mostrato un certo grado di attività spermicida, mentre la serotonina non ha mostrato alcun effetto negativo effetto sul numero di spermatozoi. La fluoxetina, che ha mostrato la più alta attività spermicida, aveva una concentrazione minima efficace paragonabile al nonoxynol-9, un contraccettivo utilizzato per le sue proprietà spermicide.6
Studi sugli animali
Molteplici studi condotti su modelli animali hanno dimostrato gli effetti negativi degli SSRI sulla fertilità maschile. La maggior parte degli studi sugli SSRI sono sulla fluoxetina, e la maggior parte mostra un certo grado di effetto gonadotossico. Ratti maschi trattati con fluoxetina orale per 60 giorni sono stati trovati ad avere una diminuzione della spermatogenesi sull’istotipo, così come una significativa diminuzione della densità e della motilità dello sperma. I ratti maschi trattati avevano anche tassi di gravidanza e di impianto ridotti rispetto alle femmine non trattate, e avevano un peso ridotto degli organi riproduttivi, compresi testicoli, epididimi, prostate e vescicole seminali.7
Uno studio simile su ratti trattati con dosi variabili di fluoxetina orale per 5 giorni ha trovato una diminuzione dose-dipendente della conta e della motilità degli spermatozoi nei ratti esposti alla fluoxetina. Alla dose più alta (13 mg/kg), la conta e la motilità degli spermatozoi erano quattro volte inferiori a quelle osservate nei controlli.8 È stato inoltre dimostrato che la somministrazione a lungo termine di fluvoxamina influisce negativamente sui parametri seminali e induce stress ossidativo e apoptosi nei testicoli dei ratti, che sono stati trattati sia con basse dosi terapeutiche (9 mg/kg) che con alte dosi dosi terapeutiche di fluoxetina (27 mg/kg) per 8 settimane.
Stress ossidativo potrebbe mediare e migliorare l’impatto negativo che questi farmaci sembrano avere sui parametri seminali. I ratti esposti a uno stress cronico imprevedibile hanno mostrato segni di stress ossidativo, tra cui un aumento dei livelli di malondialdeide e corticosterone, e una diminuzione degli antiossidanti, del numero e della motilità degli spermatozoi. Questi effetti erano esagerati negli animali trattati con fluoxetina (10 mg/kg/giorno per 28 giorni), e mitigato nei gruppi trattati con resveratrolo (20 mg/kg/giorno per 28 giorni) o fluoxetina più resveratrolo.10
Uno studio ha esaminato gli effetti della sertralina sul sistema riproduttivo dei ratti trattati con 5, 10 o 20 mg/kg per 4 settimane. C’è stato un aumento dose-dipendente dei danni al DNA (misurato con il test Comet), della degenerazione testicolare e delle forme anormali dello sperma, così come una diminuzione del numero di spermatozoi negli animali trattati. La diminuzione dei livelli di glutatione e l’aumento dei livelli di malondialdeide hanno suggerito lo stress ossidativo come meccanismo principale della tossicità testicolare osservata.11
È stato anche dimostrato che il Citalopram esercita effetti tossici su sperma e testicoli, in gran parte attraverso lo stress ossidativo. Attia e Bakheet hanno visto un aumento dipendente dalla dose e dalla durata delle rotture del filamento di DNA, danni ossidativi al DNA e spermatociti primari anormali nei ratti maschi trattati con citalopram.12 Uno studio di Ilgin et al. ha trovato risultati simili, con ratti somministrati con citalopram che mostravano un numero ridotto di spermatozoi, un aumento della morfologia anormale dello sperma e danni al DNA.13
Questi farmaci potrebbero influenzare in modo diverso gli animali pre e postpuberali, e uno studio che ha esaminato ratti pre e postpuberali trattati con fluoxetina per 30-53 giorni ha scoperto che queste due popolazioni hanno avuto risposte diverse. Anche se tutti gli animali hanno avuto una diminuzione di LH, FSH, progesterone e testosterone, i ratti prepuberali avevano più probabilità di mostrare una diminuzione dell’integrità, densità, motilità e morfologia delle memorie spermatiche rispetto alle loro controparti adulte.14
Questo potrebbe avere implicazioni per i maschi che assumono questi farmaci a partire dalla giovane età. L’uso materno di SSRI durante la gravidanza e l’allattamento potrebbe anche avere un impatto sulla qualità dello sperma nella prole maschile. È stato dimostrato che i ratti esposti alla fluoxetina in utero e durante l’allattamento hanno diminuito la massa delle vescicole seminali e la conta degli spermatozoi, così come l’altezza e il diametro ridotti dei tubuli seminiferi.15
Studi sull’uomo
I dati umani supportano costantemente un’associazione tra infertilità maschile (parametri seminali e frammentazione del DNA dello sperma) e uso di SSRI. Nel 2007, Tanrikut e Schlegel hanno descritto casi di oligospermia, motilità compromessa e morfologia anormale in due pazienti che assumono SSRIs per la depressione. Il primo paziente si è presentato al citalopram con “marcata oligospermia e 1% di motilità”. L’analisi dello sperma 1 mese dopo l’interruzione del citalopram ha mostrato un marcato miglioramento di tutti i parametri entro i limiti della norma. Il bupropione è stato iniziato per la depressione poco dopo, e un’analisi dello sperma durante il bupropione ha mostrato di nuovo una diminuzione della concentrazione di sperma a 21 milioni/mL con il 10% di motilità. Dopo due tentativi falliti di fecondazione in vitro, il paziente è stato rivalutato (sempre sotto bupropione).
La sua frammentazione del DNA (testata dal test strutturale della cromatina spermatica) era del 76%. È stato svezzato dal bupropione e la sua analisi dello sperma di follow-up 1 mese dopo la sospensione del bupropione ha mostrato una normale concentrazione di spermatozoi di 41 milioni/mL con il 75% di motilità. Una seconda analisi dello sperma effettuata 2 mesi dopo l’interruzione del bupropione ha mostrato una normale concentrazione e motilità degli spermatozoi.
Un modello simile (parametri seminali compromessi con la sertralina [concentrazione di spermatozoi di 20 000 con lo 0% di motilità]), con un miglioramento drammatico dopo l’interruzione dell’SSRI (3 mesi dopo l’interruzione 40 milioni di spermatozoi mobili) è stato visto per il secondo paziente descritto che assumeva sertralina.16 La spermatogenesi umana dura 72 giorni, e quindi questo marcato miglioramento entro poche settimane dalla sospensione dell’antidepressivo suggerisce che gli SSRI potrebbero esercitare i loro effetti sui processi post-testicolari piuttosto che sulla spermatogenesi stessa.17
Analogamente, Elnazer e Baldwin hanno descritto un paziente con un netto miglioramento della concentrazione spermatica, della motilità progressiva e della morfologia dopo la sospensione del citalopram.18 In un successivo studio prospettico, Tanrikut et al. hanno esaminato gli effetti della paroxetina sui parametri seminali e sulla frammentazione del DNA in 35 volontari maschi sani con normali parametri seminali e frammentazione del DNA (misurata con il test TUNEL). I partecipanti allo studio (età media 34 anni, range 19-58 anni) sono stati trattati con paroxetina terapeutica per 5 settimane. I parametri dello sperma e la frammentazione del DNA spermatico sono stati testati prima del trattamento e di nuovo dopo un periodo di washout di 1 mese.
L’uso della paroxetina è stato associato a un aumento significativo della frammentazione del DNA, dal 14% al basale al 30% dopo il trattamento. Inoltre, il numero di uomini con un’elevata frammentazione del DNA spermatico >30% è aumentato dal 10% al basale al 50% dopo il trattamento (odds ratio 9, intervallo di confidenza 2,3- 38). In contrasto con alcuni altri studi, questi autori non hanno identificato un cambiamento nei parametri seminali con l’uso di SSRI.19 Questo suggerisce che, sebbene i parametri seminali grezzi possano essere influenzati dall’uso di SSRI, la frammentazione del DNA spermatico potrebbe essere influenzata anche in assenza di cambiamenti nei parametri seminali e potrebbe rappresentare un mezzo alternativo per la compromissione del potenziale riproduttivo maschile.
Dati prospettici hanno anche sostenuto una relazione tra l’uso di SSRI e i marcatori di infertilità maschile. In uno studio clinico randomizzato e in cieco, 60 uomini sono stati trattati per l’eiaculazione precoce primaria con sertralina o con una terapia comportamentale non farmacologica. Il gruppo sertralina è stato trattato con sertralina 25 mg/giorno per 1 settimana, seguita da 50 mg/giorno per 3 mesi. Sia la concentrazione di sperma (riduzione di 105/mL) che la percentuale di morfologia normale erano significativamente diminuite nel gruppo sertralina rispetto ai controlli. Anche la frammentazione del DNA (metodo della dispersione della cromatina spermatica) era aumentata nel gruppo trattato (31% vs 16%).20 Un altro studio prospettico di Koyuncu et al. ha mostrato una diminuzione della concentrazione spermatica (26,4 9 106/mL vs 68,9 106/mL), della motilità (23,4% vs 58,2%) e della morfologia (23,4% vs 58,2%) dopo 3 mesi di esposizione a escitalopram per il trattamento dell’eiaculazione precoce.21
Altri fattori, tra cui la durata dell’uso di SSRI e il BMI, potrebbero influenzare negativamente i parametri dello sperma in modo sinergico. Uno studio trasversale ha confrontato i parametri seminali e la frammentazione del DNA degli spermatozoi negli uomini che assumono SSRI rispetto a quelli di uomini sani, e ha anche incluso una valutazione della durata dell’uso di antidepressivi. Gli uomini che assumevano SSRIs sono risultati avere conteggi di sperma significativamente più bassi (61 milioni vs 184 milioni), motilità (49% vs 66%) e normale morfologia (8% vs 20%), così come quantità significativamente aumentate di DNA spermatico frammentato rispetto ai controlli (43% vs 21%).
Tutte le differenze nei parametri seminali e nella frammentazione del DNA spermatico erano correlate alla durata dell’uso di antidepressivi (6-12 mesi vs 1-2 anni), anche se non sono state osservate differenze tra antidepressivi specifici all’interno della classe SSRI.22 Un altro studio su 530 uomini di età compresa tra i 18 e i 50 anni che esaminava l’effetto del BMI ha scoperto che l’uso di SSRI combinati era associato a una diminuzione significativa della motilità dello sperma, indipendente dal BMI.23
Gli studi in vitro, sugli animali e sull’uomo hanno tutti mostrato un declino della qualità dello sperma con l’uso di SSRI, come manifestato sia da parametri seminali alterati che da un aumento dei tassi di frammentazione del DNA. La durata del recupero (<73 giorni, il tempo necessario per la spermatogenesi) ai parametri seminali di base e alla frammentazione del DNA suggerisce che questi effetti potrebbero essere dovuti a qualche tipo di processo postesico. Data l’ampia prevalenza dell’uso di questa classe di farmaci, c’è una chiara necessità di ulteriori studi su larga scala, randomizzati e controllati con placebo per caratterizzare ulteriormente il ruolo degli SSRI nell’infertilità, e il loro effetto sui parametri seminali e altri marcatori della fertilità maschile.
SNRI e NDRI
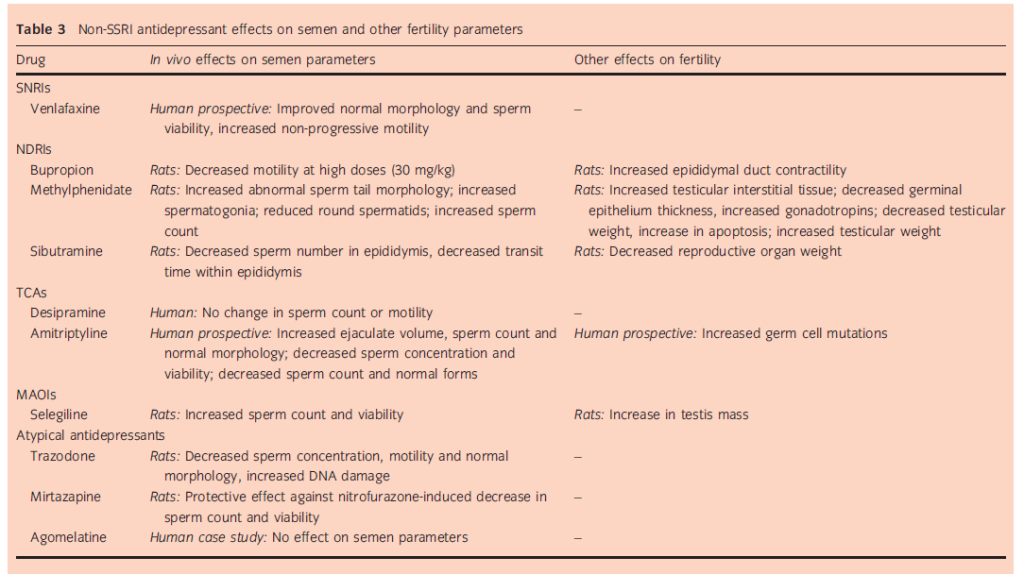
Gli SNRI esercitano i loro effetti inibendo il riassorbimento della serotonina e della norepinefrina. Questa classe di farmaci comprende desvenlafaxina, duloxetina, levomilnacipran e venlafaxina. La prevalenza di disfunzioni sessuali è del 58-70% nei pazienti trattati con SNRIs,4 in generale leggermente inferiore a quella osservata per gli SSRIs. C’è stato un solo studio che ha esaminato gli effetti di uno di questi farmaci sui parametri seminali (tabella 3). Questo gruppo ha esaminato 40 topi maschi adulti a cui è stata somministrata venlafaxina per via orale (2 mg/kg) o venlafaxina (2 mg/ kg) più vitamina C (10 mg/kg) per 35 giorni.
I topi trattati con la sola venlafaxina avevano una migliore morfologia dello sperma (58,50% vs 43,71%), motilità non progressiva (25,50% vs 16,25%) e vitalità dello sperma (80,25% vs 64,62%) rispetto ai controlli. Si pensa che questo effetto sia il risultato delle proprietà antiossidanti della venlafaxina nel proteggere dalla perossidazione lipidica. Non ci sono state differenze significative tra i parametri dello sperma nei topi trattati con la sola venlafaxina e quelli trattati con la combinazione venlafaxina e di venlafaxina e acido ascorbico.24
Gli NDRI agiscono bloccando la ricaptazione di noradrenalina e dopamina dal terminale sinaptico, aumentando così la loro biodisponibilità. Questa classe comprende bupropione, dexmetilphenidate, difenilprolinolo, etilfenidato, metilendioxypyrovalerone, metilfenidato, pipradrol, prolintane e sibutramina. In generale, i limitati dati disponibili per questi farmaci mostrano effetti diversi sui parametri seminali (Tabella 3).
Il bupropione è comunemente usato in combinazione con altri farmaci nel trattamento della depressione, così come per la cessazione del fumo. Anche se il ruolo della dopamina nella fisiologia riproduttiva non è stato chiaramente stabilito, ci sono dati limitati che implicano un qualche ruolo nella funzione riproduttiva maschile. Urra et al. hanno identificato per primi la presenza di trasportatori funzionali di dopamina nello sperma equino. Nel presente studio, alti livelli di dopamina erano associati a una diminuzione della motilità totale e progressiva degli spermatozoi, e questo effetto era parzialmente invertito dall’aggiunta di bupropione. Il blocco del trasportatore della dopamina ha ridotto l’assorbimento di un analogo della dopamina, diminuendo così l’accumulo della catecolamina nello sperma equino25 .
Un altro studio ha valutato gli effetti del bupropione sui parametri dello sperma e sulla contrattilità del dotto epididimale nei ratti. A dosi più basse (15 mg/kg), il bupropione ha aumentato la contrattilità del dotto epididimale, ma non ha avuto alcun effetto sui parametri seminali. A dosi più elevate (30 mg/kg), il farmaco ha dimostrato di compromettere la motilità dello sperma.26
Il metilfenidato è uno psicostimolante che inibisce la ricaptazione di noradrenalina e dopamina. Attualmente è usato soprattutto nel trattamento del disturbo da deficit di attenzione/iperattività nei bambini e negli adolescenti. In passato è stato usato come antidepressivo, e ci sono alcuni dati contrastanti sul suo effetto sui parametri seminali. Motagnini et al. hanno studiato gli effetti della somministrazione di metilfenidato sui ratti durante l’infanzia e lo sviluppo del giovane adulto. È stato osservato un aumento della morfologia anomala della coda dello sperma, così come un aumento del tessuto interstiziale testicolare negli animali trattati.27
Un diverso studio sui ratti ha rilevato che il trattamento con metilfenidato era associato a una diminuzione dello spessore dell’epitelio germinale, nonché a un aumento del numero di spermatogoni, probabilmente secondario all’aumento dei livelli di gonadotropina nel siero.28 Infine, uno studio sui ratti di Cansu et al. ha mostrato un’associazione dose-dipendente tra l’esposizione di 90 giorni al metilfenidato e un ridotto numero di spermatidi rotondi, una diminuzione del peso testicolare e un aumento dell’apoptosi (metodo TUNEL) e dell’espressione di p53.29 Al contrario, Adriani et al. hanno scoperto che i ratti adolescenti esposti al metilfenidato avevano un aumento del peso testicolare e una maggiore conta spermatica da adulti.30
Questi dati sono contraddittori, e non ci sono dati umani, rendendo difficile conoscere veramente l’effetto del metilfenidato sui parametri seminali e sulla fertilità maschile. La sibutramina, inizialmente sviluppata per l’uso nel trattamento della depressione, è un inibitore della ricaptazione delle monoamine comunemente usato per la perdita di peso oggi. Non ci sono studi sull’uomo per la sibutramina e solo un singolo studio sugli animali. Bellentani et al. hanno trovato che l’esposizione a 10 mg/kg di sibutramina per 28 giorni ha diminuito il peso degli organi riproduttivi nei ratti maschi, tra cui la prostata ventrale e l’epididimo, anche se non ci sono stati cambiamenti istologici notato in questi organi.
Il numero di spermatozoi nell’epididimo (180,98 9 106/organo vs 276,16 9 106/organo) e il tempo di transito nell’epididimo (4,73 giorni vs.7,85 giorni) erano anche significativamente diminuiti. Non ci sono stati cambiamenti nel numero di spermatidi nei testicoli, nella produzione giornaliera di sperma, nella motilità dello sperma o nella morfologia tra i gruppi.31 C’è una netta mancanza di dati per molti di questi farmaci. Non ci sono studi per duloxetina, desvenlafaxina, levomacipran, dexmetilfenidato, difenilprolinolo, etilfenidato, metilendiossipirovalerone, pipradrol o prolintane. Pochi dati esistono per venlafaxina, bupropione, metilfenidato e sibutramina. Gli studi clinici prospettici che esplorano gli effetti degli SNRI e degli NDRI sulla qualità dello sperma non sono ancora stati condotti. Dati i risultati contrastanti trovati negli studi preliminari sugli animali, c’è un chiaro bisogno di ulteriori ricerche in questo settore.
TCA
I TCA, tra cui amitriptilina, nortriptilina, amoxapina, desipramina, doxepina, imipramina, protriptilina e trimipramina, sono stati uno dei primi farmaci usati per trattare la depressione. Tuttavia, generalmente non sono più utilizzati come farmaci di prima linea a causa dei significativi effetti collaterali. La prevalenza stimata di disfunzioni sessuali negli uomini e nelle donne che assumono TCA è relativamente bassa, circa il 30%.4 Le prove riguardanti gli effetti dei TCA sulla qualità dello sperma sono scarse (Tabella 3). Esiste un piccolo numero di studi sulla desimina e sull’amitriptilina, ma nessuno studio su nortriptilina, amoxapina, doxepina, imipramina, protriptilina o trimipramina.
Uno studio del 1981 di Levin et al. ha descritto sia studi in vitro che studi clinici che esaminano l’effetto della desipramina sui parametri seminali. In vitro, la desipramina era associata a un’inibizione dose-dipendente della motilità dello sperma. Tuttavia, la valutazione clinica in vivo non ha trovato alcuna differenza nella conta o nella motilità degli spermatozoi tra i gruppi di trattamento e di controllo. Il trattamento con desipramina è stato associato ad una diminuzione della vitalità degli spermatozoi (definita come la percentuale di spermatozoi mobili, non è stato effettuato un vero test di vitalità). Altri parametri seminali non differivano significativamente tra i gruppi di trattamento e di gruppi di controllo.32
Ci sono stati quattro studi che hanno esaminato l’amitriptilina, con risultati contrastanti. Un piccolo studio sugli effetti dell’amitriptilina in 20 uomini infertili con oligospermia ha trovato un aumento del volume dell’eiaculato, del numero di spermatozoi e una morfologia normale dopo il trattamento con amitriptilina. La conta degli spermatozoi è aumentata nel 50% dei pazienti e la motilità nel 35% dei pazienti.33 Al contrario, Bandegi et al. hanno trovato effetti negativi dell’amitriptilina sui parametri seminali nei ratti trattati con amitriptilina da sola rispetto all’amitriptilina e all’acido ascorbico. I ratti trattati con amitriptilina da sola avevano uno sperma più basso di concentrazione (18,11 milioni contro 22,41 milioni) e vitalità (31,25% contro 64,62%) rispetto ai controlli.
Questi risultati sono stati osservati anche confrontando il gruppo che riceveva amitriptilina più acido ascorbico e i controlli, e l’aggiunta di acido ascorbico non sembrava mitigare questo effetto.24 Due studi suggeriscono che l’amitriptilina ha un effetto mutageno sullo sperma. Uno studio di Chowdary e Rao ha mostrato effetti mutageni dell’amitriptilina nelle cellule germinali di topi trattati con varie dosi orali dell’antidepressivo.34 Risultati simili sono stati ottenuti in uno studio su animali in cui l’amitriptilina è risultata aumentare le anomalie cromosomiche e diminuire il numero e la morfologia normale dello sperma.35
IMAO
I TCA, tra cui amitriptilina, nortriptilina, amoxapina, desipramina, doxepina, imipramina, protriptilina e trimipramina, sono stati uno dei primi farmaci usati per trattare la depressione. Tuttavia, generalmente non sono più utilizzati come farmaci di prima linea a causa dei significativi effetti collaterali. La prevalenza stimata di disfunzioni sessuali negli uomini e nelle donne che assumono TCA è relativamente bassa, circa il 30%.4 Le prove riguardanti gli effetti dei TCA sulla qualità dello sperma sono scarse (Tabella 3). Esiste un piccolo numero di studi sulla desimina e sull’amitriptilina, ma nessuno studio su nortriptilina, amoxapina, doxepina, imipramina, protriptilina o trimipramina.
Uno studio del 1981 di Levin et al. ha descritto sia studi in vitro che studi clinici che esaminano l’effetto della desipramina sui parametri seminali. In vitro, la desipramina era associata a un’inibizione dose-dipendente della motilità dello sperma. Tuttavia, la valutazione clinica in vivo non ha trovato alcuna differenza nella conta o nella motilità degli spermatozoi tra i gruppi di trattamento e di controllo. Il trattamento con desipramina è stato associato ad una diminuzione della vitalità degli spermatozoi (definita come la percentuale di spermatozoi mobili, non è stato effettuato un vero test di vitalità). Altri parametri seminali non differivano significativamente tra i gruppi di trattamento e di gruppi di controllo.32
Ci sono stati quattro studi che hanno esaminato l’amitriptilina, con risultati contrastanti. Un piccolo studio sugli effetti dell’amitriptilina in 20 uomini infertili con oligospermia ha trovato un aumento del volume dell’eiaculato, del numero di spermatozoi e una morfologia normale dopo il trattamento con amitriptilina. La conta degli spermatozoi è aumentata nel 50% dei pazienti e la motilità nel 35% dei pazienti.33 Al contrario, Bandegi et al. hanno trovato effetti negativi dell’amitriptilina sui parametri seminali nei ratti trattati con amitriptilina da sola rispetto all’amitriptilina e all’acido ascorbico. I ratti trattati con amitriptilina da sola avevano uno sperma più basso di concentrazione (18,11 milioni contro 22,41 milioni) e vitalità (31,25% contro 64,62%) rispetto ai controlli.
Questi risultati sono stati osservati anche confrontando il gruppo che riceveva amitriptilina più acido ascorbico e i controlli, e l’aggiunta di acido ascorbico non sembrava mitigare questo effetto.24 Due studi suggeriscono che l’amitriptilina ha un effetto mutageno sullo sperma. Uno studio di Chowdary e Rao ha mostrato effetti mutageni dell’amitriptilina nelle cellule germinali di topi trattati con varie dosi orali dell’antidepressivo.34 Risultati simili sono stati ottenuti in uno studio su animali in cui l’amitriptilina è risultata aumentare le anomalie cromosomiche e diminuire il numero e la morfologia normale dello sperma.35
Antidepressivi atipici
Gli antidepressivi atipici sono quelli che agiscono con meccanismi separati da quelli discussi sopra. Questi farmaci includono mirtazapina, trazodone, nefazodone, tianeptina, agomelatina, vilazodone e vortioxetina. Ci sono dati limitati riguardanti gli effetti di questi farmaci sulla fertilità attraverso i parametri seminali, anche se i dati disponibili suggeriscono un effetto negativo sulla qualità dello sperma (Tabella 3).
Uno studio su ratti che ricevevano (controllo), 5, 10 o 20 mg/ kg/giorno di trazodone per 28 giorni consecutivi ha riscontrato una diminuzione della concentrazione di sperma (4,68 x 106/mL, 3,04 x 106/mL, 2,84 x 106/mL e 2,68 x 106/mL, rispettivamente), della motilità dello sperma (86,49%, 80,06%, 78,85% e 76,23%, rispettivamente) e una normale morfologia (18,00%, 28,90%, 31,20% e 37,08% di forme anormali, rispettivamente), così come un aumento dei danni al DNA nei ratti trattati. L’aumento dei livelli di malondialdeide ha suggerito che lo stress ossidativo ha contribuito alla tossicità testicolare in questi animali.38 Analogamente, Cassidy e Pearson hanno dimostrato che il trazodone ha un effetto inibitorio sulla motilità in campioni in vitro di sperma umano.39
La mirtazapina ha dimostrato in uno studio di avere un effetto protettivo contro lo stress ossidativo e il danno testicolare. In questo studio, il danno testicolare nei ratti è stato indotto dalla somministrazione di nitrofurazone. I ratti esposti profilatticamente alla mirtazapina 1 settimana prima dell’inizio del nitrofurazone hanno avuto un declino significativamente meno pronunciato della conta e della vitalità degli spermatozoi rispetto a quelli che hanno ricevuto solo nitrofurazone, così come una diminuzione degli indicatori di danno ossidativo.40
Un caso di studio ha suggerito che l’agomelatina (rispetto al citalopram) non ha un impatto negativo sulla qualità dello sperma (almeno in un paziente). Elnazer e Baldwin hanno descritto un caso di diminuzione della concentrazione spermatica, della motilità, della motilità progressiva e della morfologia normofila in un paziente trattato con citalopram per depressione mista e ansia. Questi effetti si sono risolti dopo la sospensione del citalopram. Il paziente è stato successivamente trattato con agomelatina, che non è stata associata a un calo dei parametri seminali.18 Non ci sono stati finora studi sugli effetti di nefazodone, tianeptina, vilazodone o vortioxetina sui parametri seminali o su altri marcatori della fertilità maschile.
Conclusioni
Dato l’uso relativamente comune dei farmaci antidepressivi, i dati limitati sul loro uso sono preoccupanti. Ciò è particolarmente preoccupante, dato che questi farmaci sono assunti da giovani uomini, generalmente a lungo termine. Non abbiamo dati sulla gravidanza o sul parto vivo per nessuno di questi farmaci. Tutti loro hanno il potenziale di influenzare le prestazioni sessuali a vari livelli.
I dati esistenti mostrano che gli SSRI esercitano un effetto dannoso sulla qualità dello sperma e sui tassi di frammentazione del DNA, oltre ad aumentare lo stress ossidativo negli organi riproduttivi. La maggior parte di questi effetti sembra essere reversibile alla cessazione del trattamento con SSRI, anche se questo potrebbe non essere possibile per tutti i pazienti che hanno bisogno di questi farmaci per controllare la loro depressione.
Ci sono prove contrastanti sul fatto che il bupropione (un NDRI) abbia un impatto negativo o positivo sulla motilità dello sperma. Allo stesso modo, i dati disponibili per il metilfenidato sono solo su animali e contraddittori, rendendo difficile conoscere il suo vero effetto. Gli studi sull’amitriptilina hanno dato risultati contraddittori, con un piccolo studio clinico che suggerisce un miglioramento dei parametri seminali in pazienti con oligospermia di base, ma tre studi sugli animali hanno riscontrato l’effetto opposto. L’unico IMAO che è stato studiato in questa arena è la selegilina, che ha dimostrato di aumentare il numero di spermatozoi e la vitalità in due studi sui ratti.
Le valutazioni degli effetti del trattamento con farmaci antidepressivi sui parametri dello sperma dovrebbero considerare anche gli effetti della depressione non trattata e dell’ansia sulla fertilità. Shiraishi e Matsuyama hanno dimostrato che le condizioni mediche in comorbilità hanno avuto un impatto negativo sulla spermatogenesi e che il trattamento delle comorbilità mediche, tra cui ipertensione, iperlipia, iperuricemia e malattie della pelle, è stato associato ad un un aumento significativo del numero di spermatozoi mobili.41
In particolare, è stato dimostrato che lo stress psicosociale ha un effetto inverso sui livelli di testosterone.42 Inoltre, non è sorprendente che una diagnosi di depressione maggiore sembri influenzare la funzione della gonade . È stato dimostrato che gli uomini con episodi depressivi di gravità da moderata a grave hanno livelli più bassi di testosterone43 , così come livelli più bassi di globulina legante gli ormoni sessuali e DHEA-S, una maggiore secrezione di cortisolo e prolattina e un minor volume di sperma e densità spermatica.44
Dato l’uso diffuso e spesso a lungo termine di farmaci antidepressivi, c’è un chiaro bisogno di ulteriori dati relativi al loro impatto sulla qualità dello sperma e sulla fertilità maschile. I dati esistenti sono spesso basati su studi su animali o sull’uomo con un basso numero di pazienti. C’è una forte assenza di dati prospettici. A questo punto, è difficile per i medici consigliare i pazienti sull’effetto che questi farmaci potrebbero avere sulla loro fertilità. Raccomandiamo una discussione informata con i pazienti che cercano di diventare genitori e che assumono questi farmaci. Il controllo di un’analisi seminale di base e della frammentazione del DNA dello sperma potrebbe fornire un certo livello di orientamento. Se possibile, si consiglia una prova di sospensione degli antidepressivi, anche se questo dovrebbe essere effettuato in collaborazione con il fornitore della salute mentale del paziente.
Bibliografia
Vedi l’articolo orginale disponibile a questo link