David Healy, MD, FRCPsych1
Pubblicato su The Canadian Journal of Psychiatry 2009
Traduzione in italiano a cura del Dott. Claudio Ajmone per GiùleManidaiBambini.org
Testo originale in inglese, disponibile a questo link
Nel 1959, in un incontro a Cambridge che celebrava l’imipramina – un potente inibitore della ricaptazione della serotonina – una serie di oratori distingueva tra il rischio riconosciuto di suicidio derivante dalla terapia elettroconvulsivante che faceva regredire il ritardo psicomotorio prima che la suicidalità depressiva fosse alleviata e l’agitazione e la suicidalità indotte dall’imipramina.1 Da allora, la saggezza clinica ricevuta in Europa era che gli antidepressivi potessero scatenare la suicidalità.
Quando arrivarono gli SSRI, gli studi controllati erano diventati un metodo importante per valutare i loro effetti clinici. Se questi studi fossero stati meta-analizzati per gli atti suicidi, è ora chiaro che a partire dal 1988 avrebbero mostrato un raddoppio del rischio di atti suicidi con gli SSRI, rispetto al placebo.2
In questo contesto, una serie di articoli tra il 1990 e il 1992 che descrivevano un’insorgenza precoce, legata alla dose, di suicidalità con la fluoxetina, che si azzerava alla sospensione e riemergeva alla riesposizione, non era sorprendente.3 Utilizzando tutti gli algoritmi di causalità standard, questi studi dimostravano un legame causale convincente tra il trattamento e gli effetti avversi.
L’articolo originale descriveva 6 casi non fatali ma ometteva una morte per suicidio in una persona di 14 anni con un disturbo ossessivo compulsivo.4 King et al5 descrivevano nei bambini effetti identici a quelli degli adulti.
Pur sostenendo che non c’era una differenza significativa nei tassi di atti suicidi tra il trattamento attivo e il placebo, tutte le meta-analisi dei dati degli studi clinici dal 1991 al 2005 hanno infatti riportato un eccesso di atti suicidi con il trattamento attivo.6 L’eccesso sarebbe stato maggiore se non fosse che queste analisi hanno incluso, sotto la voce placebo, atti avvenuti durante la fase pre- e (o) post-randomizzazione degli studi analizzati.6
Un’analisi del 2003 di studi controllati con placebo sugli antidepressivi nell’ansia ha concluso – sulla base di 11 suicidi in 12.914 pazienti in trattamento attivo, rispetto a 0 suicidi in 3875 pazienti in placebo – che l’ansia era un fattore di rischio per il suicidio, suggerendo un profondo pregiudizio contro il riconoscimento dei rischi derivanti dal trattamento.7
Nel 2004, il rischio di suicidio degli antidepressivi è venuto alla ribalta come legato alla possibile inefficacia di questi agenti nei bambini, fornendo la prova di una diffusa mancanza di segnalazione delle prove e di ghostwriting di quelle pubblicate. Le analisi dei dati della FDA hanno confermato un raddoppio del rischio di comportamenti suicidi con il trattamento attivo, rispetto al placebo.
Tra coloro che sono preoccupati che questi dati possano dissuadere i pazienti dal cercare il trattamento, è stato sostenuto che: non ci sono stati in realtà morti per suicidio in questi studi, l’aumento del rischio può derivare da pazienti su agenti attivi che verbalizzano la loro ideazione o atti, e, dal lancio degli SSRI, i tassi di suicidio nazionali sono ampiamente diminuiti.
Una serie di articoli ha mostrato che i tassi di atti suicidi diminuiscono nei pazienti depressi dopo l’istituzione del trattamento, e ci sono stati suggerimenti di un aumento dei tassi di suicidio pediatrico negli Stati Uniti e in Olanda da quando sono state messe le avvertenze sugli antidepressivi, anche se questi studi non controllati possono dimostrare poco più del fatto che i pazienti con qualsiasi condizione, dall’influenza alla depressione, cercano o ricevono un trattamento quando sono al peggio, e la storia naturale di questi disturbi porta ad un miglioramento nel periodo post-consulto, anche se non sono disponibili trattamenti efficaci.
L’argomento dei tassi di suicidio nazionali omette i dati degli anni ’60 e ’70, quando i tassi di suicidio nazionali salirono, anche se le prescrizioni di antidepressivi tra quelli a maggior rischio di suicidio sono aumentate al massimo.
I dati degli anni ’90 non riescono a distinguere tra l’80% degli antidepressivi somministrati in trattamenti a lungo termine a pazienti a basso rischio per il loro trattamento e il gruppo a rischio di pazienti alla prima esposizione che assumono forse non più del 20% delle prescrizioni di antidepressivi in un anno.
Una volta fatte queste distinzioni, è possibile conciliare una maggiore esposizione a un rischio indotto dal trattamento con il calo dei tassi di suicidio nazionali.8 Inoltre, c’è una chiara evidenza che durante il periodo in cui sia i tassi di suicidio nazionali che le prescrizioni di antidepressivi sono aumentati, sono aumentati anche i tassi di autopsia, mentre il recente calo dei tassi di suicidio coincide con la diminuzione dei tassi di autopsia e l’aumento dei tassi di morte per cause non specificate.9
Fattori come questi devono essere presi in considerazione se vogliamo evitare lo scenario degli anni ’60, quando le compagnie del tabacco negavano l’esistenza di un legame tra il fumo e il cancro ai polmoni o i disturbi cardiaci, sulla base di 60 anni di dati nazionali che mostravano un calo dei decessi per cause respiratorie e cardiache e un aumento dell’aspettativa di vita in coincidenza con un maggiore consumo di sigarette.10
Gli RCT offrono una certa protezione contro i rischi di confondimento inerenti ai dati di grandi coorti non controllate. Nessun RCT antidepressivo è stato progettato per esaminare la suicidalità indotta dal trattamento. Dato questo, le morti per suicidio offrono il risultato meno ambiguo, gli atti suicidari un risultato meno certo, e l’ideazione suicidaria un risultato più ambiguo.
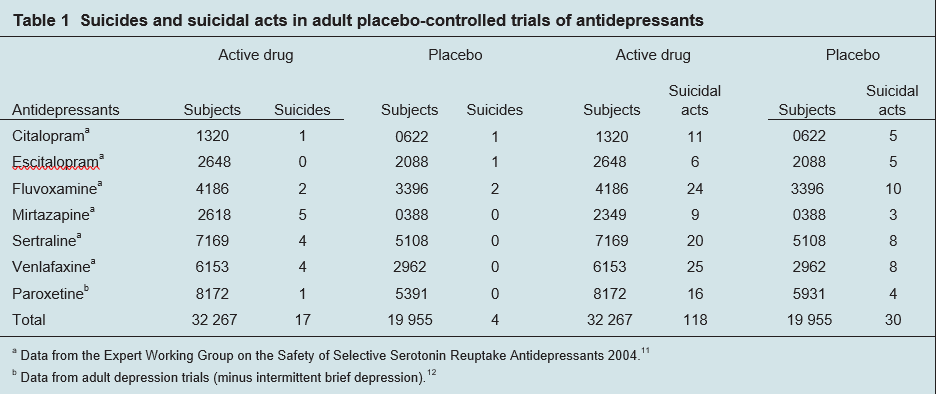
I dati della revisione dei comportamenti suicidi pubblicati dal regolatore britannico nel 2004 mostrano un aumento di 2,62 volte dei suicidi compiuti (95% CI da 0,89 a 7,81) e di 2,4 volte (95% CI 1,63 a 3,63) aumento del rischio relativo nei suicidi e negli atti suicidi combinati su agenti attivi, rispetto al placebo (Tabella 1).
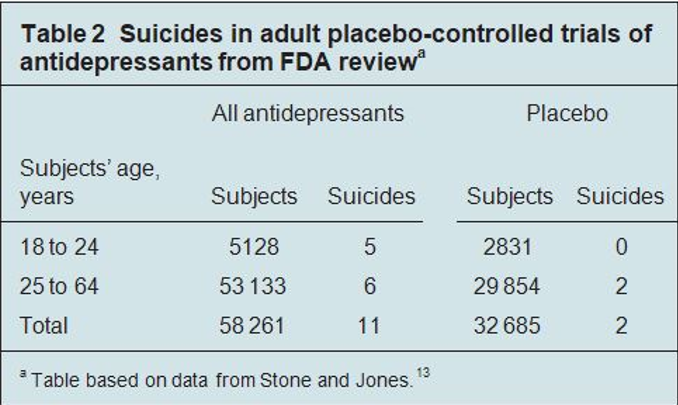
I dati della recente revisione della FDA degli studi sugli adulti (Tabella 2) mostrano un rischio relativo di morte per suicidio aumentato di 3,09 volte (95% CI da 0,68 a 13,9) nelle persone di età compresa tra 18 e 64 anni, rispetto al placebo. C’è stato un aumento di 2,3 volte del tasso di comportamenti suicidi nelle persone di età compresa tra 18 e 24 anni, un rischio relativo di 0,9 volte di comportamenti suicidi nelle persone di età compresa tra 25 e 44 anni, e un rischio relativo di 1,75 di comportamenti suicidi nelle persone di età compresa tra 45 e 64 anni, rispetto al placebo. C’è stato un aumento complessivo del rischio di comportamenti suicidi per le persone di età compresa tra i 18 e i 64 anni, ma un rischio ridotto rispetto al rischio suicidio.
Ci sono discrepanze tra i dati riportati dai regolatori britannici e americani e altri dati di dominio pubblico. Ci possono essere numerose ragioni per le continue disparità. Una ragione risiede nell’inclusione inappropriata in certe analisi dei dati di 2 studi sulla paroxetina, 057 e 106, in cui 298 pazienti, principalmente nel gruppo di età compresa tra 25 e 44 anni, hanno avuto 77 atti suicidi. Per esempio, l’inclusione di questi dati nella tabella 1 ridurrebbe il rischio relativo di atti suicidi da 2,43 a 1,43.
Vale la pena notare che, in risposta all’affermazione che non ci sono stati suicidi negli studi pediatrici sugli antidepressivi, è più preciso affermare che non sono stati registrati suicidi. Un gran numero di pazienti in questi studi ha abbandonato a causa di eventi avversi ed è stato perso al follow-up. Dato il tasso di suicidi nei dati dell’FDA per le persone di età compresa tra i 18 e i 24 anni (che non include tutte le morti adolescenziali per suicidio da studi controllati con placebo), sarebbe imprudente scartare la possibilità che ci siano stati effettivamente suicidi negli studi pediatrici. Vale anche la pena notare che i dati sui suicidi e sugli atti suicidi sono in contrasto con i dati sull’ideazione suicidaria e suggeriscono che non c’era un bias di segnalazione.
Cosa si può imparare da questo?
Primo, gli antidepressivi presentano un rischio di suicidio in tutte le fasce d’età. In secondo luogo, dopo che 100.000 pazienti sono stati inseriti in studi controllati con placebo, e più di un migliaio di trials aziendali di antidepressivi, sembra straordinario che i clinici non possano abbinare specifiche farmacoterapie ai loro pazienti.
C’è ancora un 50-50 di possibilità che al prossimo paziente a cui viene prescritto uno di questi farmaci, di qualsiasi fascia d’età, venga prescritto il farmaco sbagliato per lui. La scienza terapeutica non si è mossa di un millimetro. In terzo luogo, gli psichiatri devono rivedere la questione di quando credere e quando non credere all’evidenza davanti ai loro occhi.
I rapporti originali sui casi erano ampiamente corretti, ma la loro verità avrebbe potuto essere facilmente nascosta. Se gli antidepressivi avessero impedito più suicidi di quelli che sembrano aver innescato in questi gruppi di pazienti, i medici di fronte a pazienti che mostravano una suicidalità de novo potrebbero non aver avuto dati per sostenere le loro argomentazioni.
Al contrario, i dati degli studi controllati indicano che i medici che trattano sia adulti che bambini sembrano sovrastimare i benefici del trattamento, affermando che i trattamenti funzionano quando l’80% della risposta è riprodotta dal placebo. I dati ora disponibili richiedono un giudizioso scetticismo riguardo ai benefici del trattamento e una reale preoccupazione per i rischi.
L’occultamento dei dati solleva preoccupazioni etiche e scientifiche sul sequestro dei dati da parte dell’azienda e sul ghostwriting dei dati sperimentali.
Finanziamento e supporto
Nessun finanziamento è stato fornito per questa ricerca. Il dottor Healy è stato consulente di Astra-Zeneca e Servier, ed è stato uno sperimentatore principale, un elenco di trial clinici, un presidente o un relatore in simposi internazionali. Ha ricevuto un sostegno per partecipare a riunioni da Astra-Zeneca e Servier, e ha ricevuto compensi per conferenze e sostegno per partecipare a riunioni da Astra-Zeneca.
Il dottor Healy ha ricevuto un compenso come testimone esperto per il querelante in 15 azioni legali riguardanti gli SSRI ed è stato consultato in numerosi casi di tentato suicidio, suicidio e casi di suicidio-omicidio a seguito di farmaci antidepressivi, nella maggior parte dei quali ha offerto il parere che il trattamento non era coinvolto. È stato anche un testimone esperto in un brevetto e in un caso di titoli.
Bibliografia
Vedi l’articolo originale disponibile a questo link