Tarang Sharma,dottorando – Louise Schow Guski, studentessa di medicina – Nanna Freund, studentessa di medicina – Peter C Gøtzsche, professore
Pubblicato su BMJ 2016
Traduzione in italiano a cura del Dott. Claudio Ajmone per GiùleManidaiBambini.org
Testo originale in inglese, disponibile a questo link
Affiliazione degli autori: Nordic Cochrane Centre, Rigshospitalet, Copenhagen, Denmark – University of Copenhagen, Faculty of Health and Medical Sciences, Denmark
Sommario
Obiettivo. Studiare i danni gravi associati agli inibitori selettivi della ricaptazione della serotonina e della serotonina-norepinefrina.
Progettazione Revisione sistematica e meta-analisi.
I principali risultati misurano la mortalità e il suicidio. Gli esiti secondari erano il comportamento aggressivo e l’acatisia.
Fonti dei dati. Rapporti di studi clinici per duloxetina, fluoxetina, paroxetina, sertralina e venlafaxina ottenuti dalle autorità europee e britanniche di regolamentazione dei farmaci e rapporti di prova sintetici per duloxetina e fluoxetina dal sito web di Eli Lilly.
Criteri di ammissibilità per la selezione degli studi. Studi in doppio cieco controllati con placebo che contenevano qualsiasi narrativa di pazienti o elenchi di danni individuali dei pazienti.
Estrazione e analisi dei dati. Due ricercatori hanno estratto i dati in modo indipendente; i risultati sono stati meta-analizzati con il metodo esatto di Peto (modello a effetto fisso).
Risultati
Sono stati inclusi 70 studi (64.381 pagine di rapporti di studi clinici) con 18.526 pazienti. Questi trials presentavano limitazioni nel disegno dello studio e discrepanze nei resoconti, che potrebbero aver portato a una grave sottostima dei danni. Ad esempio, alcuni risultati apparivano solo negli elenchi dei singoli pazienti in appendici, che avevamo solo per 32 studi, e non avevamo moduli di segnalazione di casi per nessuno degli studi. Le differenze di mortalità (tutti i decessi sono stati negli adulti, odds ratio 1,28, intervallo di confidenza 95% da 0,40 a 4,06), suicidalità (1,21, 0,84-1,74) e acatisia (2,04, 0,93-4,48) non erano significative, mentre i pazienti che assumevano antidepressivi mostravano comportamento più aggressivo (1,93, 1,26-2,95). Per gli adulti, gli odds ratio erano 0,81 (da 0,51 a 1,28) per il suicidio, 1,09 (da 0,55 a 2,14) per l’aggressività e 2,00 (da 0,79 a 5,04) per l’acatisia. I valori corrispondenti per bambini e adolescenti erano 2,39 (da 1,31 a 4,33), 2,79 (da 1,62 a 4,81) e 2,15 (da 0,48 a 9,65). Nei rapporti di prova sommari sul sito Web di Eli Lilly, sono stati annotati quasi tutti i decessi, ma mancavano tutti gli eventi di ideazione suicidaria e le informazioni sui risultati rimanenti erano incomplete.
Conclusioni
A causa delle carenze individuate e avendo accesso solo parziale alle appendici senza accesso ai moduli di segnalazione dei casi, i danni non potevano essere stimati con precisione. Negli adulti non c’è stato un aumento significativo in tutti e quattro gli esiti, ma nei bambini e negli adolescenti il rischio di suicidio e aggressività è raddoppiato. Per chiarire i danni in modo affidabile, è necessario l’accesso ai dati anonimi dei singoli pazienti.
Introduzione
Gli inibitori selettivi della ricaptazione della serotonina (SSRI) e gli inibitori della ricaptazione della serotonina-norepinefrina (SNRI) sono alcuni dei farmaci più comunemente prescritti. 1 2 Il suicidio indotto da SSRI è stato segnalato per la prima volta nel 1990 3 ma è stato generalmente riconosciuto solo dopo che un programma della BBC Panorama si è concentrato su di esso nel 2002. 4 Una revisione del Regno Unito del 2004 ha mostrato una notevole discrepanza tra studi pubblicati e non pubblicati e un aumento del comportamento suicida nei bambini e negli adolescenti (di età inferiore ai 18 anni), 5 che ha portato a gravi avvertenze contro questi farmaci utilizzati in questa fascia di età. 6
È opinione diffusa che il rischio di suicidio non aumenti negli adulti e il supporto per questo è stato fornito da una meta-analisi della Food and Drug Administration di circa 100.000 pazienti.7 Tuttavia, un’ampia revisione sistematica degli studi pubblicati ha rilevato un aumento dei tentativi di suicidio con il trattamento con SSRI, 1 e un’altra revisione che utilizza i dati presentati alla Medicines and Healthcare products Regulatory Agency (MHRA) del Regno Unito non ha potuto escludere un aumento del rischio di comportamento suicidario durante il trattamento precoce con questi farmaci. 8
Per il comportamento aggressivo (ad esempio, ostilità, aggressione) in generale, i rapporti sono in conflitto. 9 10 11 12 13 14 15 Una revisione del Regno Unito utilizzando i dati MHRA ha rilevato un aumento dell’ostilità nei bambini e negli adolescenti,16 e un’analisi degli eventi avversi segnalati alla FDA ha mostrato che gli antidepressivi erano coinvolti in modo sproporzionato nei casi di violenza, compreso l’omicidio.17 Sono stati segnalati molti casi di comportamento aggressivo, 2 4 ma, a differenza del suicidio, è stata intrapresa poca ricerca sistematica. È stato spesso segnalato che gli autori di sparatorie nelle scuole e di eventi simili sono consumatori di antidepressivi 18 e in molti casi i tribunali li hanno giudicati non colpevoli a causa della pazzia indotta dal farmaco. 4
L’acatisia è una forma estrema di irrequietezza, che alcuni pazienti descrivono come il desiderio di “saltare fuori dalla loro pelle”, che può aumentare il rischio di suicidio e violenza. 2 4 11 19 20 21 22 23 24 Il Manuale Diagnostico e Statistico dei Disturbi Mentali descrive l’acatisia o sintomi di attivazione simili come “disturbo del movimento indotto da farmaci non altrimenti specificato”. 26
I rapporti degli studi clinici sono riepiloghi dettagliati dei risultati degli studi preparati dall’industria farmaceutica per essere sottoposti alle autorità di regolamentazione per ottenere l’autorizzazione all’immissione in commercio. Una recente revisione dei rapporti degli studi clinici ha mostrato che le informazioni essenziali sugli esiti rilevanti per il paziente spesso mancavano negli articoli pubblicati. 27 Una ricerca condotta dal nostro centro utilizzando nove rapporti di studi clinici su duloxetina ha rilevato che i dati sui danni maggiori mancavano dagli articoli di riviste e nei rapporti di prova di sintesi. 28
Non abbiamo avuto accesso ad alcun modulo di segnalazione dei casi (questionari cartacei o elettronici che contengono i dati raccolti su ciascun partecipante allo studio), sebbene sarebbero stati la fonte di informazioni ideale. 28 Riportiamo qui i nostri risultati per mortalità, suicidio, aggressività e acatisia sulla base di rapporti di studi clinici per cinque diversi antidepressivi.
Metodi
Nel 2011, abbiamo richiesto rapporti di studi clinici su SSRI e SNRI dall’Agenzia europea per i medicinali e dall’MHRA del Regno Unito. Non abbiamo avuto accesso ai rapporti degli studi clinici per tutti gli studi o per tutti i farmaci comunemente prescritti e non abbiamo ricevuto i moduli dei rapporti sui casi per nessuno degli studi. Un ricercatore (TS) ha selezionato quei rapporti di studi clinici che descrivevano studi in doppio cieco controllati con placebo e che contenevano racconti dei pazienti (brevi riassunti di decessi, eventi avversi gravi o altri eventi di importanza clinica) o elenchi di eventi avversi nei singoli pazienti (con dettagli come l’identificativo del paziente, l’evento avverso (termine preferito e termine letterale), durata, gravità e risultato). 28
Siamo stati in grado di includere cinque farmaci: duloxetina, fluoxetina, paroxetina, sertralina e venlafaxina (o venlafaxina a rilascio prolungato). Abbiamo convertito i rapporti degli studi clinici in un formato di documento portatile leggibile e un ricercatore (TS) ha copiato tutte le pagine pertinenti, con le informazioni sullo studio, i protocolli, tutti i riepiloghi e le tabelle degli eventi avversi, le appendici pertinenti (se disponibili), i racconti dei pazienti e gli elenchi dei singoli pazienti — Per l’uso nell’estrazione dei dati.
In qualità di pilota, abbiamo scelto casualmente un report per ciascun farmaco e lo abbiamo letto nella sua interezza per aiutare a comprendere i diversi formati dei report degli studi clinici e per perfezionare il modulo di estrazione dei dati. Avevamo programmato che il secondo osservatore avrebbe estratto i dati alla cieca, con i gruppi di trattamento mascherati, ma il pilota ha mostrato che il formato e il linguaggio utilizzati rendevano impossibile l’accecamento. Il ricercatore principale (TS) e un secondo osservatore (LSJ o NF) hanno estratto i dati dalle pagine selezionate di tutti i rapporti degli studi clinici in modo indipendente; i disaccordi sono stati risolti attraverso la discussione e documentati utilizzando le statistiche κ (vedere dati supplementari A).
Risultati
Gli esiti primari erano la mortalità e la propensione al suicidio (suicidio, tentativo di suicidio o comportamento preparatorio, autolesionismo intenzionale e ideazione suicidaria); gli esiti secondari erano il comportamento aggressivo e l’acatisia. Per identificare gli esiti primari, abbiamo utilizzato gli stessi termini e frasi di quelli della FDA 7 29 e abbiamo aggiunto termini ulteriori dal nostro progetto pilota. Abbiamo cercato i rapporti degli studi clinici sia elettronicamente che manualmente. Per le persone con più di un evento di suicidio, abbiamo contato solo quello più grave, mentre questo non era possibile per gli esiti secondari, che ci hanno permesso di contare solo gli eventi. I termini per il comportamento aggressivo sono stati informati dal pilota e l’acatisia è stata identificata cercando “acatisia” nel testo (vedi dati supplementari A). Tutti gli eventi rilevanti sono stati classificati utilizzando ilDizionario di codifica del Medical Dictionary for Regulatory Activities (MedDRA).
Per la duloxetina e la fluoxetina, abbiamo confrontato i dati con i rapporti riassuntivi degli studi dal sito web di Eli Lilly. 30 Per la meta-analisi di eventi rari, abbiamo riportato gli odds ratio utilizzando il metodo esatto di Peto e calcolato gli intervalli di confidenza al 95% con un modello a effetti fissi utilizzando RevMan 5.3. 31 32 Sono stati inclusi tutti gli eventi di post-randomizzazione, quindi quando erano disponibili i dati delle fasi di lead-out e post-trattamento, li abbiamo combinati con i dati della fase randomizzata. Negli studi con più bracci di intervento, abbiamo aggiunto aritmeticamente i dati sui bracci per ottenere un braccio farmacologico combinato. Abbiamo pianificato e condotto analisi di sottogruppi per adulti per tutti i risultati e per suicidi e tentativi di suicidio combinati, e abbiamo fatto analisi post-hoc per suicidi e bambini e adolescenti e un’analisi di sensibilità rimuovendo i dati dai centri fraudolenti, come suggerito dai revisori tra pari.
Coinvolgimento del paziente
Nessun paziente è stato coinvolto nella definizione della domanda di ricerca o delle misure di esito, né è stato coinvolto nella progettazione e nell’attuazione dello studio. Abbiamo in programma di coinvolgere le organizzazioni di pazienti nella diffusione dei nostri risultati.
Risultati
Sono stati esclusi 125 dei 198 rapporti di studi clinici: 96 non erano studi in doppio cieco controllati con placebo, 28 erano studi su volontari sani e uno era uno studio crossover (figura 1). Dei restanti 73 rapporti di studi clinici, ne abbiamo esclusi cinque che non avevano narrazioni di pazienti o elenchi di eventi avversi individuali. I 68 rapporti di studi clinici inclusi ammontavano a 64.381 pagine e corrispondevano a 70 studi.
Caratteristiche della prova e disegno dello studio
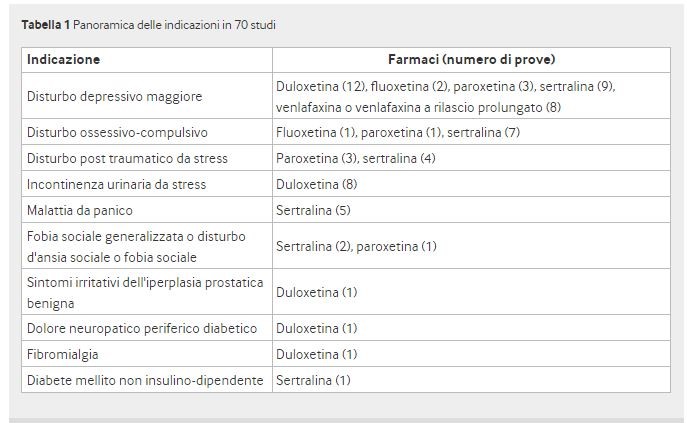
I farmaci sperimentali erano duloxetina (23 studi), fluoxetina (n = 3), paroxetina (n = 8), sertralina (n = 28) e venlafaxina (n = 8). In totale, 10.258 pazienti hanno ricevuto un farmaco e 6832 un placebo. Quindici studi avevano un comparatore aggiuntivo (SSRI o SNRI) in 669 pazienti (228 che ricevevano fluoxetina e 441 che ricevevano paroxetina) e un comparatore triciclico o tetraciclico in 767 pazienti. Undici degli studi (12% dei pazienti) riguardavano bambini e adolescenti. Tabella 1 mostra le indicazioni per il trattamento; 34 studi includevano 7882 pazienti con disturbo depressivo maggiore. I pazienti a rischio di suicidio sono stati esclusi in 44 studi (63%); in 16 studi, il rischio di suicidio non era un criterio di esclusione (23%), mentre era sconosciuto in 10 studi (14%). La fase randomizzata degli studi è durata da una a 54 settimane (mediana nove settimane).
Sessanta studi (86%) hanno avuto un periodo di introduzione al placebo (da 4 a 14 giorni, mediana di 7 giorni) e tutti hanno escluso dalla randomizzazione coloro che sono migliorati durante il trattamento con placebo, come giudicato dai loro punteggi Hamilton o simili. Raramente c’erano informazioni sui numeri esclusi.
Non era chiaro in che misura i sedativi fossero consentiti o usati. Quattro studi sulla duloxetina e quattro sulla sertralina hanno consentito l’uso di benzodiazepine o farmaci psicoattivi simili. Tuttavia, in almeno 50 studi (71%, non avevamo accesso al protocollo completo per tutti gli studi), i sedativi come l’idrato corale o lo zolpidem erano consentiti se i pazienti avevano difficoltà a dormire.
La qualità delle relazioni sugli studi clinici variava. Per 32 studi abbiamo avuto elenchi dei singoli pazienti degli eventi avversi per tutti i pazienti (in appendici, a parte gli studi sulla venlafaxina in cui gli elenchi facevano parte del rapporto principale). Abbiamo avuto accesso al protocollo per 44 prove; per gli studi rimanenti era disponibile solo un riassunto del disegno dello studio. Sembrava che tutte le altre appendici fossero o solo “disponibili su richiesta” per le autorità o rientrassero nel “sistema di eccezioni stabilito nel regolamento (CE) n. 1049/2001” e quindi non potessero essere rilasciate a noi.
Ciò è in linea con le linee guida per i rapporti degli studi clinici, per i quali non è necessario presentare alcune appendici all’EMA. 33 Per 27 studi, avevamo solo rapporti di studi clinici abbreviati o sommari; alcuni di questi sono stati intitolati di conseguenza mentre altri sono stati chiamati rapporti di studi clinici, sebbene fossero solo brevi riassunti di circa 100 pagine. Per quattro prove di sertralina, abbiamo avuto solo rapporti di sintesi che combinano due prove ciascuna (prove 51 e 52 e prove 53 e 54) per le quali i protocolli erano gli stessi. Abbiamo analizzato i risultati di conseguenza. Le caratteristiche chiave degli studi inclusi sono disponibili nei dati supplementari B.
Le aziende farmaceutiche avevano dubbi sulla validità dei dati o su comportamenti fraudolenti in tre studi. I dati di un centro nello studio 28 non sono stati inclusi nelle analisi di efficacia “a causa di preoccupazioni sulla validità dei dati” e nello studio 34, un centro è stato chiuso “a seguito di un audit interno che ha rilevato violazioni significative della conformità”. Quattro centri nel processo 70 hanno mostrato comportamenti potenzialmente fraudolenti: tre centri hanno avuto i loro registri di studio “sequestrati dalla polizia svizzera per frode”; e per il quarto centro, “Molti dei pazienti arruolati. . . ha avuto valutazioni identiche per visite consecutive, e. . . tutti i 35 pazienti di questo sito avevano modelli di valutazione molto simili. “
L’accordo tra gli osservatori per le nostre valutazioni è stato elevato (κ = 0,94). La maggior parte dei disaccordi è derivata da errori nell’estrazione dei dati; la discussione e il consenso sono stati necessari solo per due eventi.
Mortalità
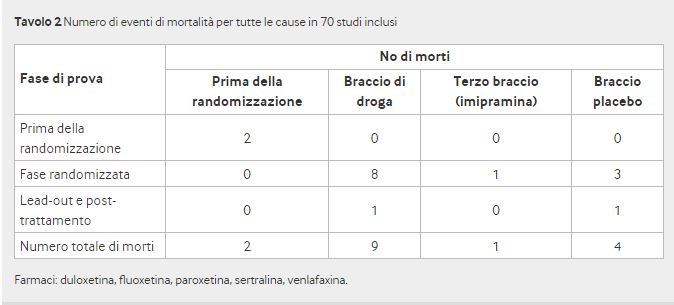
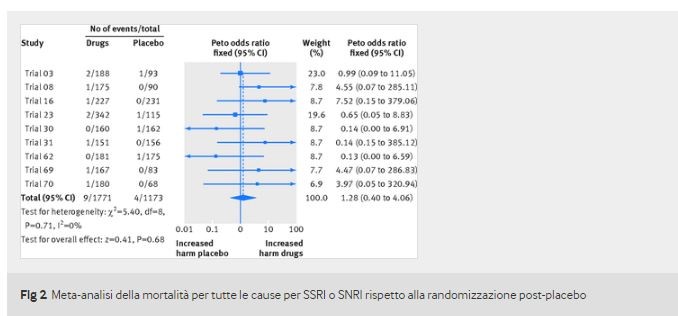
Si sono verificati sedici decessi, tutti negli adulti: uno nella fase di induzione del placebo e uno in una fase di induzione di 12 settimane durante il trattamento con duloxetina 60 mg / die. Dopo la randomizzazione, nove decessi si sono verificati durante il trattamento con SSRI o SNRI e quattro con placebo (odds ratio 1,28, intervallo di confidenza al 95% da 0,40 a 4,06) più uno con imipramina (tabella 2, figura 2 e dati supplementari C). Poiché nessuno dei decessi si è verificato in centri fraudolenti, non è stata necessaria alcuna analisi di sensibilità.
Quattro decessi sono stati riportati in modo errato dalla società, favorendo in tutti i casi il farmaco attivo. Un decesso in un partecipante che riceveva paroxetina (studio 31) è stato definito evento post-studio, avvenuto 21 giorni dopo che il paziente aveva ammesso di prendere l’ultima dose, ma questo era il giorno 63 degli 84 giorni di trattamento randomizzato. Inoltre, il paziente aveva paroxetina rilevabile nel sangue al momento della morte.
Un paziente che riceveva venlafaxina (prova 69) ha tentato il suicidio per strangolamento senza preavviso ed è morto cinque giorni dopo in ospedale. Sebbene il tentativo di suicidio sia avvenuto il 21 ° giorno dei 56 giorni di trattamento randomizzato, la morte è stata definita evento post-studio poiché si è verificata in ospedale e il trattamento era stato interrotto a causa del tentativo di suicidio.
Al contrario, un paziente che riceveva placebo (studio 62) è morto il giorno 404, 26 giorni dopo la fine della fase randomizzata, ma la morte non è stata elencata come un evento post-studio poiché il paziente avrebbe assunto il trattamento fino al giorno precedente.
Infine, una morte in un partecipante che riceveva venlafaxina (studio 70) avvenuta tre mesi dopo il trattamento è stata annotata solo nelle narrazioni del paziente e in nessun altro posto nel rapporto dello studio clinico.
Suicidalità
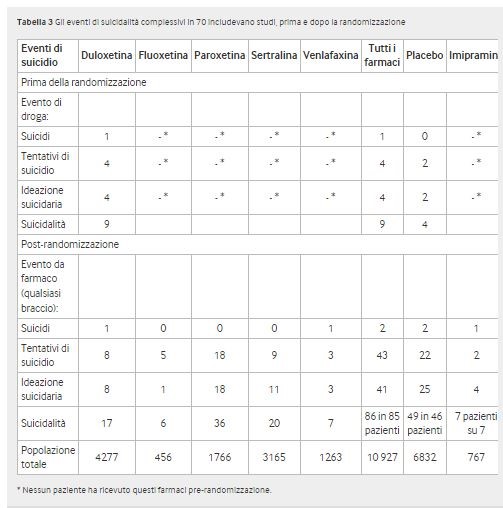
Complessivamente, si sono verificati 155 eventi di suicidio, 13 prima della randomizzazione. L’odds ratio post-randomizzazione per suicidio nei pazienti è stato di 1,21 (intervallo di confidenza al 95% da 0,84 a 1,74) ed era simile per il numero di eventi di suicidio (1,14, 0,80-1,64). L’odds ratio per il suicidio negli adulti era 0,81 (da 0,51 a 1,28) e 0,77 (da 0,49 a 1,21 per gli eventi) e per i bambini e gli adolescenti era 2,39 (da 1,31 a 4,33) e 2,24 (da 1,24 a 4,04 per gli eventi). Nessuno degli eventi di suicidio si è verificato in pazienti provenienti da centri fraudolenti. Vedi tabella 3, fig 3 e dati supplementari C e D.
Meta-analisi della suicidalità nei partecipanti che ricevono inibitori selettivi della ricaptazione della serotonina (ssris)
o inibitori della ricaptazione della serotonina-norepinefrina (snris) rispetto al placebo dopo la randomizzazione
Suicidi
Sono stati segnalati sei suicidi, uno nella fase iniziale di duloxetina. Dopo la randomizzazione sono stati segnalati cinque suicidi: due nel gruppo farmaco in studio, due nel gruppo placebo (odds ratio 0,58, intervallo di confidenza 95% da 0,07 a 4,48) e uno nel gruppo imipramina (vedere dati supplementari C e D).
Tentativi di suicidio
Abbiamo contato tutti i tentativi di suicidio, inclusi autolesionismo intenzionale (ad esempio, taglio dei polsi), overdose intenzionali e ovvi eventi preparatori (ad esempio, mettere un coltello al polso o al collo, ma essere fermati prima di qualsiasi danno). Sei dei 73 eventi (n = 70 pazienti) si sono verificati prima della randomizzazione (quattro nei partecipanti che assumevano duloxetina e due nei partecipanti che assumevano placebo).
Uno degli eventi, in un partecipante che assumeva il placebo prima della randomizzazione, si è verificato il giorno 29, sebbene la fase iniziale avrebbe dovuto durare solo 14 giorni. Inoltre, uno dei quattro tentativi di suicidio nei partecipanti che assumevano duloxetina prima della randomizzazione è stato identificato solo esaminando le appendici contenenti elenchi dei singoli pazienti. Questo “possibile tentativo di suicidio” è stato elencato come “lieve” e non è stato documentato altrove nel rapporto dello studio clinico e non c’era alcuna narrazione del paziente.
Cinque dei 67 eventi post-randomizzazione si sono verificati durante la fase di lead-out o post-trattamento degli studi (in tre pazienti che ricevevano i farmaci in studio e in due che ricevevano placebo). Dei restanti 62 tentativi di suicidio (in 59 pazienti), 40 si sono verificati in 39 pazienti che ricevevano il farmaco in studio, 20 in 18 pazienti che ricevevano placebo e due su due pazienti che ricevevano imipramina. Quattro di questi eventi sono stati elencati solo negli elenchi dei singoli pazienti e altri tre sono stati annotati solo nelle tabelle degli eventi avversi (non erano disponibili ulteriori informazioni in quanto non vi era narrativa).
Ventisette eventi sono stati codificati come labilità emotiva o peggioramento della depressione, sebbene nelle narrazioni dei pazienti o negli elenchi dei singoli pazienti fossero chiaramente tentativi di suicidio. Al contrario, diversi casi di ideazione suicidaria sono stati chiamati tentativi di suicidio nelle tabelle degli eventi avversi. Un tentativo di suicidio (sovradosaggio intenzionale con paracetamolo (acetaminofene) in un paziente che riceveva fluoxetina è stato descritto come “enzimi epatici elevati” nelle tabelle degli eventi avversi, in contrasto con la narrazione (vedi dati supplementari C). Non c’era differenza tra suicidi e tentativi di suicidio (odds ratio 1,05, intervallo di confidenza al 95% 0,63-1,75). L’odds ratio per gli adulti era 0,60 (0,29-1,24) e per bambini e adolescenti era 1,85 (0,90-3,83, vedere dati supplementari D).
Ideazione suicidaria
Settantacinque partecipanti hanno sperimentato 76 eventi di ideazione suicidaria, di cui sei eventi erano nella fase iniziale (quattro stavano assumendo duloxetina e due placebo). Due dei quattro eventi nelle utilizzatrici di duloxetina erano gravi e avevano narrazioni di pazienti. Un terzo evento è stato lieve ed è stato registrato solo nelle tabelle degli eventi avversi emergenti dal trattamento. Il quarto evento, pensieri suicidi lievi, è apparso solo nell’appendice contenente gli elenchi dei singoli pazienti. Dei 70 eventi post-randomizzazione, 41 si sono verificati nei partecipanti che ricevevano i farmaci in studio, 25 in quelli che ricevevano placebo e quattro in quelli che ricevevano imipramina.
Sessantadue pazienti hanno sperimentato 63 eventi durante la fase randomizzata degli studi (34 eventi in quelli che ricevevano farmaci, 25 su 24 partecipanti che ricevevano placebo e quattro nei partecipanti che ricevevano imipramina). Trentadue di questi eventi sono stati codificati come labilità emotiva o peggioramento della depressione nelle tabelle degli eventi avversi emergenti dal trattamento, ma era chiaro dalle narrazioni dei pazienti o dagli elenchi dei singoli pazienti che erano in realtà eventi di ideazione. Sette eventi si sono verificati nelle fasi di lead-out o post-trattamento degli studi e tutti nei partecipanti che ricevevano il farmaco in studio (vedere dati supplementari C).
Comportamento aggressivo
Tre eventi di comportamento aggressivo nei partecipanti che ricevevano duloxetina e due nei partecipanti che ricevevano placebo si sono verificati prima della randomizzazione. Dopo la randomizzazione si sono verificati 62 eventi nei partecipanti che ricevevano i farmaci in studio, 28 nei partecipanti che ricevevano placebo e quattro nei partecipanti che ricevevano imipramina, di cui tre nel gruppo paroxetina e due nel gruppo placebo si sono verificati nel lead-out o dopo il trattamento fase (tabella 4). Il comportamento aggressivo si è verificato più spesso nel gruppo farmacologico rispetto al gruppo placebo (odds ratio 1,93, intervallo di confidenza 95% 1,26-2,95). L’odds ratio per gli adulti era 1,09 (da 0,55 a 2,14) e per i bambini e gli adolescenti era 2,79 (da 1,62 a 4,81, figura 4). Se i dati sono stati rimossi dagli studi 28 e 34 (studi pediatrici in cui ogni centro aveva dati fraudolenti), l’aumento dell’aggressività è rimasto: tutte le età 1,58 (da 1,00 a 2,51) e solo bambini e adolescenti 2,19 (da 1,17 a 4,11, vedere i dati supplementari D).

Meta-analisi del comportamento aggressivo in pazienti che ricevono inibitori selettivi della ricaptazione della serotonina (ssris) o inibitori della ricaptazione della serotonina-norepinefrina (snris) rispetto al placebo dopo la randomizzazione
Solo i racconti dei pazienti per eventi gravi erano disponibili e includevano minaccia omicida, ideazione omicida, aggressione, molestie sessuali e una minaccia di portare una pistola a scuola (tutti e cinque i partecipanti ricevevano sertralina), danni alla proprietà, pugni oggetti domestici, aggressione aggressiva, minacce verbalmente violente e aggressive (tutti e cinque i partecipanti che ricevono paroxetina) e belligeranza (fluoxetina). I dettagli non erano disponibili per gli eventi non gravi, poiché erano elencati nelle tabelle degli eventi avversi o forniti nell’appendice degli elenchi dei singoli pazienti senza alcuna narrazione. Questi eventi sono stati una maggiore ostilità, aggressività, rabbia o rabbia.
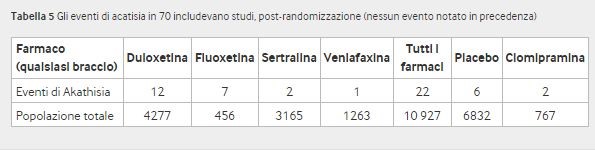
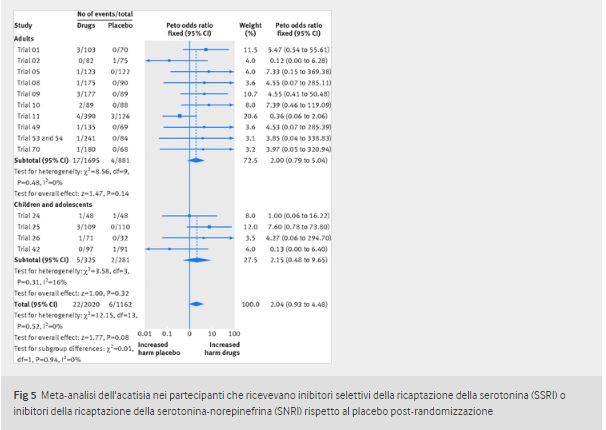
Acatisia Si sono verificati trenta eventi di acatisia, tutti post-randomizzazione (22 nei partecipanti che ricevevano i farmaci in studio, sei nei partecipanti che ricevevano il placebo e due nei partecipanti che ricevevano la clomipramina); due degli eventi, entrambi in partecipanti trattati con duloxetina, si sono svolti nella fase di lead-out (tabella 5). L’acatisia si è verificata più spesso nei partecipanti che ricevevano il farmaco in studio rispetto a quelli che ricevevano placebo (2,04, da 0,93 a 4,48), ma questa differenza non era statisticamente significativa: per gli adulti 2,00 (da 0,79 a 5,04) e per i bambini e gli adolescenti (2,15, da 0,48 a 9,65 , fig 5). Se i dati sono stati rimossi dallo studio 70 (adulti), in cui alcuni centri avevano dati fraudolenti, l’odds ratio diventa 1,99 (da 0,90 a 4,44) e per gli adulti diventa 1,94 (da 0,75 a 4,99, vedere dati supplementari D).
Alcuni eventi non sono stati elencati come acatisia nelle tabelle degli eventi avversi a causa dei dizionari di codifica utilizzati. Ad esempio, nei tre studi sulla sertralina in cui abbiamo avuto accesso sia al termine verbatim che a quello codificato preferito, l’acatisia sembrava essere stata codificata come “ipercinesia” secondo il dizionario di terminologia delle reazioni avverse ai farmaci dell’Organizzazione mondiale della sanità. Potremmo identificare l’acatisia solo se avessimo accesso ai termini letterali, che a volte erano disponibili dagli elenchi dei singoli pazienti o dai racconti dei pazienti. Per la maggior parte degli studi su duloxetina e fluoxetina, l’acatisia è stata notata anche nelle tabelle degli eventi avversi regolari, e quindi gli studi sembravano avere più eventi rispetto a quelli per altri farmaci per i quali l’acatisia era codificata in modo errato – ad esempio, non sono stati riportati casi di acatisia nei trials della paroxetina. Questi eventi sarebbero saltati negli studi in cui tali informazioni dettagliate non erano disponibili. Pertanto, è probabile che il nostro numero di eventi di acatisia sia sottostimato, poiché l’evento sembrava essere stato codificato in molti altri termini di attivazione, come irritabilità, agitazione o nervosismo.
Confronto dei nostri dati con i rapporti di prova di sintesi sul sito web di Eli Lilly
Le informazioni sugli eventi avversi in questi rapporti di sintesi erano limitate e non attendibili. Il numero di eventi gravi è stato sempre menzionato ma i casi non sono stati sempre spiegati e le segnalazioni si sono concentrate sugli eventi avversi più comuni. Tutte le segnalazioni contenevano tabelle di eventi avversi emergenti dal trattamento, ma non per tutti i pazienti (ad eccezione degli studi 23 e 26 in cui erano stati tabulati dati completi) e nella maggior parte dei casi gli eventi venivano mostrati solo se si erano verificati, ad esempio, almeno nel 5% dei pazienti. Non siamo stati in grado di trovare i rapporti di sintesi online per quattro studi (studi 19-22, tutti su duloxetina).
Tutti gli otto decessi (sei nei partecipanti che hanno ricevuto duloxetina e due nei partecipanti che hanno ricevuto placebo) dopo la randomizzazione sono stati annotati nei riassunti online, sebbene mancassero le informazioni su un suicidio in un partecipante che riceveva duloxetina nella fase in aperto prima della randomizzazione nello studio 7, poiché nessun dato di quella fase era disponibile online. Solo due (entrambi i partecipanti che ricevevano fluoxetina) dei 20 tentativi di suicidio (14 partecipanti che ricevevano duloxetina, tre fluoxetina e tre placebo) sono stati documentati nei riassunti e nessuno dei 14 eventi di ideazione suicidaria (otto nei partecipanti che ricevevano duloxetina, due paroxetina, una fluoxetina e tre placebo) sono stati menzionati.
Solo 10 (tre partecipanti che hanno ricevuto fluoxetina e sette placebo) dei 25 eventi di comportamento aggressivo (cinque partecipanti che hanno ricevuto duloxetina, sei fluoxetina e 14 placebo) sono stati trovati online. Solo tre eventi di acatisia (tutti i partecipanti che ricevevano fluoxetina) dei 17 (10 che ricevevano duloxetina, cinque fluoxetina, e due placebo) erano nelle sintesi. Tuttavia, il caso degli “enzimi epatici elevati” in un paziente che riceveva fluoxetina nello studio 26 è stato chiarito come un sovradosaggio intenzionale.
Discussione
Discussione
Sono necessarie revisioni sistematiche dei danni per una visione equilibrata degli interventi medici, in particolare per chiarire il verificarsi di eventi rari ma gravi. 34 I rapporti degli studi clinici sono molto più affidabili dei rapporti degli studi pubblicati, 2 4 28 ma anche usando questi non siamo stati in grado di svelare il numero reale di danni gravi. Le sperimentazioni presentavano molti difetti, sia nella progettazione che nella rendicontazione delle sperimentazioni nei rapporti degli studi clinici, e quindi è probabile che i nostri numeri siano sottostimati. I rapporti di sintesi sul sito web di Eli Lilly erano ancora più inaffidabili di quanto sospettassimo in precedenza. 28 Solo la mortalità aveva informazioni (quasi) complete.
Confronto con altri studi
Non abbiamo trovato differenze significative nella mortalità o nella tendenza al suicidio in generale, ma i nostri dati hanno confermato l’aumento del rischio di suicidio nei bambini e negli adolescenti. 5 16 Volevamo chiarire questi rischi negli adulti e non abbiamo riscontrato un aumento significativo dell’associazione con i farmaci, simile alle analisi precedenti. 7 8 I nostri risultati, tuttavia, non possono essere facilmente confrontati con i risultati della meta-analisi FDA del 2006 7 poiché avevamo i dati di 18.526 pazienti, mentre la FDA includeva circa 100 000 pazienti. La FDA non ha considerato i limiti degli studi che abbiamo identificato e ne ha introdotti alcuni, ad esempio contando solo gli eventi entro 24 ore dalla fine della fase randomizzata. Abbiamo contato tutti gli eventi post-randomizzazione nel nostro studio, sebbene non fossero sempre disponibili.
È interessante notare che un dipendente della FDA ha pubblicato un documento nel 2001 utilizzando i dati della FDA che mostravano 22 suicidi in 22.062 pazienti randomizzati ad antidepressivi, 35 che equivale a 10 su 10.000 abitanti, ma nella vasta meta-analisi della FDA cinque anni dopo, cinque suicidi erano riportato in 52.960 pazienti, o 1 su 10.000 abitanti. 7
Anche una revisione con oltre 40.000 pazienti che utilizzavano i dati presentati alla Medicines and Healthcare products Regulatory Agency (MHRA) del Regno Unito non ha rilevato un aumento del rischio di suicidio negli adulti che utilizzano inibitori della ricaptazione della serotonina (SSRI), ma ha osservato che la frequenza relativa di autolesionismo e pensieri suicidari negli studi rispetto al suicidio hanno indicato che gli endpoint non fatali erano sottostimati. 8 Un’altra revisione, con 87 650 pazienti (di tutte le età), ha riportato un raddoppio delle probabilità di tentativi di suicidio, che era statisticamente significativo 1 , in contrasto con i nostri risultati negli adulti. Come nel nostro studio, entrambe le revisioni hanno riscontrato gravi limitazioni negli studi e prove di sottostima di gravi danni.
Questa sottostima è stata confermata anche nella recente ripubblicazione da parte di ricercatori indipendenti dello studio 329 sulla paroxetina nei bambini e negli adolescenti. 36 Non abbiamo avuto accesso alle appendici di questo studio, che contenevano gli elenchi dei singoli pazienti. Molti eventi suicidi sono stati documentati solo lì, e ancora più eventi suicidi sono stati identificati solo nei moduli di segnalazione del caso, a cui gli investigatori hanno avuto accesso dopo lunghe trattative con GlaxoSmithKline e solo attraverso un’interfaccia desktop remoto a schermo singolo, il che ha reso impossibile per il ricercatori di esaminare tutte le 77 000 pagine. 36
Abbiamo scoperto che il rischio di comportamento aggressivo era raddoppiato con l’uso di antidepressivi (a tutte le età), che era un risultato statisticamente significativo, ma quando abbiamo limitato la nostra analisi agli adulti, non c’era tale effetto. Tuttavia, abbiamo riscontrato un raddoppio del rischio per bambini e adolescenti, il che è coerente con la maggiore incidenza di ostilità rilevata dall’MHRA. 16 Abbiamo scoperto che l’acatisia era molto sottostimata. L’acatisia si è verificata più spesso nei partecipanti che ricevevano farmaci rispetto al placebo, sia nei bambini che negli adolescenti e negli adulti, ma la differenza non era significativa (tutte le età, odds ratio 2,04, intervallo di confidenza al 95% da 0,93 a 4,48). Abbiamo anche trovato risultati simili in una revisione sistematica di studi su volontari adulti sani che includevano dati di 10 studi pubblicati e due studi non pubblicati (rapporti di studi clinici ottenuti dall’EMA). Rispetto al placebo (n = 226), gli antidepressivi (n = 318) erano associati a un aumento del tasso di attivazione o ad altri eventi precursori di aggressività e suicidio (odds ratio 1,81, intervallo di confidenza 95% 1,05-3,12). 37
Limitazioni negli studi e nei rapporti degli studi clinici
Nella maggior parte degli studi (86%), i pazienti sono stati randomizzati solo se non sono riusciti a migliorare nel periodo di introduzione del placebo. Un ampio studio ha avuto un periodo in aperto di 12 settimane in cui 533 pazienti hanno ricevuto duloxetina e solo 278 pazienti (52%) che hanno tollerato il farmaco sono stati randomizzati. Ciò dà origine a un bias di selezione basato sulla risposta, che ha un impatto sulla successiva fase randomizzata. Durante quel periodo in aperto per duloxetina, ci fu un suicidio (per impiccagione), quattro tentativi di suicidio e quattro eventi di ideazione suicidaria.
Un altro problema era rappresentato dai periodi di introduzione insufficienti. 4 24 Almeno 36 studi hanno avuto periodi di wash-out insufficienti, della durata di pochi giorni o di una settimana. Altre nove prove non hanno avuto alcun periodo di introduzione. Anche quando è stato specificato un periodo di introduzione del placebo, non è stato sempre rispettato, ad esempio, in uno studio con venlafaxina (studio 70), il periodo di wash-out è stato inadeguato in 30 pazienti che hanno ricevuto farmaci prima dello studio e in una sertralina studio (studio 50) è stato affermato che “alcuni pazienti hanno proceduto al trattamento in doppio cieco senza un precedente run-in con placebo”. Poiché i pazienti spesso ricevono già un trattamento con farmaci simili, alcuni possono sviluppare effetti di astinenza quando passano a un placebo, 2 4 12 14 23 24 che possono essere erroneamente considerati eventi avversi.
Questi danni iatrogeni possono essere notevoli. In un ampio studio supportato da Eli Lilly, i sintomi di astinenza sono stati registrati nei pazienti durante un periodo di 5-8 giorni; 4-24 mesi dopo la remissione della depressione. Il placebo è stato sostituito con il farmaco attivo, sconosciuto ai pazienti, e quando i pazienti sono passati al placebo, circa un terzo che riceveva sertralina o paroxetina è diventato agitato, irritabile, ha riferito un peggioramento dell’umore e il loro punteggio di depressione di Hamilton è aumentato di almeno 8. 38
La maggior parte degli studi non ha riportato eventi post-trattamento. Come notato in precedenza, la FDA ha incluso eventi che si verificano entro le prime 24 ore dopo la fine della fase randomizzata. 7 Per gli studi sulla sertralina negli adulti (tabella del rapporto 30; abbiamo rianalizzato questi dati di sintesi), non vi è stato alcun aumento del rischio di suicidio o tentativi di suicidio (rapporto di rischio 0,87, intervallo di confidenza al 95% 0,31-2,48). 7 Quando Pfizer ha analizzato i suoi dati dei trials, i risultati sembravano molto migliori per la sertralina (abbiamo rianalizzato i loro dati per suicidio o tentativi di suicidio); rapporto di rischio 0,52 (0,17-1,59). 39
Tuttavia, Pfizer ha pubblicato un’analisi aggiuntiva in cui i pazienti sono stati seguiti per 30 giorni dopo la fine della fase randomizzata e quindi la sertralina non sembrava proteggere dai suicidi o dai tentativi di suicidio negli adulti, ma piuttosto sembrava causarli (abbiamo rianalizzato i loro dati, rapporto di rischio 1,47, 0,77-2,83), anche se questi risultati non erano significativi. 39 Gli investigatori che hanno utilizzato i dati MHRA 8 hanno scoperto che quando sono stati inclusi eventi dopo 24 ore, il rischio di suicidio o autolesionismo è stato raddoppiato con la sertralina: abbiamo rianalizzato i dati (rapporto di rischio 2,14, 0,96-4,75), sebbene gli esiti non erano statisticamente significativi (vedi dati supplementari D). 7
Un’altra limitazione era l’uso di diversi dizionari di codifica; 32 studi (46%) non hanno dichiarato quale hanno usato. Sedici degli studi sulla sertralina hanno utilizzato la terminologia delle reazioni avverse ai farmaci dell’Organizzazione mondiale della sanità e, poiché non consente la codifica di acatisia o ideazione suicidaria, è molto probabile che tali eventi vengano sottostimati nella nostra revisione.
Inoltre, abbiamo scoperto che molti eventi di ideazione suicidaria sono stati codificati come “peggioramento della depressione” o “labilità emotiva” nelle tabelle degli eventi avversi emergenti dal trattamento negli studi sulla paroxetina, che utilizzavano il proprio dizionario (Adverse Drug Experience Coding System, ADECS), come stato notato da altri studi. 36 40 Solo uno studio (studio 27) ha menzionato questo problema nel rapporto dello studio clinico, in cui si afferma che “la labilità emotiva cattura eventi come ideazioni/gesti suicidari e overdose”. Non siamo riusciti a trovare alcun evento di acatisia negli studi con paroxetina, poiché non avevamo accesso ai termini letterali e gli eventi sono stati codificati come altri termini di attivazione nonostante l’acatisia fosse il termine preferito nel dizionario dei simboli di codifica per un thesaurus dei termini di reazione avversa, su cui si basa ADECS. 41
In molti degli studi sono stati utilizzati tranquillanti minori e sonniferi, che tendono a nascondere gli eventi di aggressività e acatisia. Inoltre, due terzi di tutti gli studi hanno escluso i pazienti a rischio di suicidio.
Punti di forza e limiti di questa recensione
Riteniamo che la nostra sia la prima revisione completa di dati di studi controllati randomizzati utilizzando rapporti di studi clinici per comportamento aggressivo e acatisia, e la nostra scoperta del raddoppio dell’aggressività nei bambini e negli adolescenti è nuova. La nostra revisione ha evidenziato i limiti negli studi, non solo nella loro progettazione ma anche nella loro segnalazione nei rapporti degli studi clinici, che potrebbero aver portato a una grave sottovalutazione dei danni.
Uno dei principali limiti della nostra revisione era che la qualità dei rapporti degli studi clinici differiva notevolmente e variava da rapporti di sintesi a rapporti completi con appendici, il che limitava la nostra capacità di rilevare i danni. Il nostro studio ha anche dimostrato che il rischio standard dello strumento di valutazione del bias era insufficiente quando i danni da antidepressivi venivano valutati nelle relazioni degli studi clinici. La maggior parte degli studi ha escluso i pazienti con rischio suicidario e quindi il nostro numero di suicidalità potrebbe essere sottostimato rispetto a quello che ci aspetteremmo nella pratica clinica. Inoltre, non avevamo accesso ai moduli di segnalazione dei casi e, a causa di problemi di codifica, abbiamo deliberatamente adottato un approccio conservativo e utilizzato un solo termine per identificare l’acatisia.
Conclusioni e implicazioni per la ricerca e la pratica
Riteniamo che il nostro studio dimostri che, nonostante l’utilizzo dei rapporti degli studi clinici, il vero rischio di danni gravi sia ancora incerto. La bassa incidenza di questi eventi rari e la cattiva progettazione e segnalazione degli studi rendono difficile ottenere stime accurate degli effetti.
La FDA ha informato che gli antidepressivi possono anche causare il suicidio nei giovani adulti (dai 18 ai 24 anni) e raccomanda che i “pazienti di tutte le età” trattati con antidepressivi debbano essere monitorati per “peggioramento clinico, tendenza al suicidio e cambiamenti insoliti nel comportamento”. 42 GlaxoSmithKline ha anche inviato lettere ai medici, informandoli sull’aumento del danno nei giovani adulti 6 e ha ammesso che per gli adulti con depressione “(tutte le età), la frequenza di comportamenti suicidari era più alta nei pazienti trattati con paroxetina rispetto al placebo: 11/3455 (0,32%) contro 1/1978 (0,05%). ” 43 Uno studio di coorte dalla Svezia ha recentemente mostrato un aumento dei crimini violenti nei giovani adulti che assumono antidepressivi (rapporto di rischio 1,43, intervallo di confidenza al 95% 1,19-1,73). 44
Pertanto suggeriamo un uso minimo di antidepressivi nei bambini, adolescenti e giovani adulti, poiché i danni gravi sembrano essere maggiori e il loro effetto sembra essere inferiore a quanto clinicamente rilevante. 4 45 46 47 Trattamenti alternativi come l’esercizio 48 49 o la psicoterapia 4 50 possono avere qualche beneficio e potrebbero essere presi in considerazione, sebbene anche gli studi di psicoterapia soffrano di bias di pubblicazione. 51
La necessità di identificare le informazioni nascoste nei rapporti degli studi clinici per formare una visione più accurata dei benefici e dei danni dei farmaci è stata evidenziata dall’iniziativa Restoring Invisible and Abandoned Trials (RIAT) 52 e dalla recente versione rivista dello studio 329. 36 Altri dati dei rapporti degli studi clinici dovrebbero essere disponibili nei prossimi anni, con la nuova politica dell’EMA di rendere disponibili pubblicamente tutti i rapporti appena presentati. 53 Poiché può essere molto laborioso eseguire revisioni sistematiche utilizzando i rapporti di studi clinici, sono necessari metodi automatizzati più affidabili per l’estrazione di testo, in modo tale che tutti i dati, inclusi quelli degli elenchi dei singoli pazienti e dei moduli dei rapporti sui casi, possano essere considerati di routine. 36 54
Cosa si sa già su questo argomento
- Informazioni importanti sui danni spesso mancano nei rapporti di prova pubblicati
- I rapporti degli studi clinici dovrebbero quindi essere la fonte preferita per le revisioni sistematiche dei farmaci
- Gli antidepressivi possono aumentare il rischio di suicidio nei bambini e negli adolescenti
Cosa aggiunge questo studio
- Nonostante tutti i limiti che abbiamo identificato negli studi e nei rapporti degli studi clinici, abbiamo riscontrato un aumento degli eventi di aggressione con antidepressivi (persi solo negli adulti), con un raddoppio sia del suicidio che dell’aggressività nei bambini e negli adolescenti
- La segnalazione selettiva dei danni rilevanti nelle diverse sezioni dei rapporti degli studi clinici significava che le narrazioni dei pazienti, le tabelle con gli elenchi dei singoli pazienti (spesso presenti nelle appendici) e i moduli dei rapporti sui casi erano necessari per informazioni complete
- I rapporti di sintesi online degli studi disponibili dal sito Web di Eli Lilly sono inadeguati come documenti di origine per l’identificazione dei dati sui danni
Note a piè di pagina
- Ringraziamo l’Agenzia europea per i medicinali e l’Agenzia di regolamentazione dei medicinali e dei prodotti sanitari per aver fornito i rapporti degli studi clinici utilizzati per questa revisione. Alcuni risultati di questo studio sono stati presentati alla conferenza Research waste / EQUATOR a Edimburgo, Scozia (settembre 2015).
- Collaboratori: tutti gli autori hanno avuto accesso completo ai dati dello studio. LSG era conosciuta con il suo nome da nubile Jensen al momento dello studio. TS e PCG hanno contribuito al concetto e alla progettazione dello studio, hanno scritto il protocollo e hanno ottenuto finanziamenti. TS, LSG e NF hanno acquisito i dati per lo studio; tutti gli autori hanno contribuito all’analisi e / o all’interpretazione dei dati. TS ha sviluppato la prima bozza del manoscritto e tutti gli autori hanno rivisto criticamente il manoscritto e approvato la versione finale. PCG è il supervisore e garante dello studio.
- Finanziamento: questo studio fa parte di una tesi di dottorato (TS), finanziata dalla Laura and John Arnold Foundation. La fonte di finanziamento non ha avuto alcun ruolo nella progettazione e nella conduzione dello studio; raccolta, gestione, analisi e interpretazione dei dati; preparazione, revisione e approvazione del manoscritto; o la decisione di presentare il paper per la pubblicazione.
- Interessi in competizione: tutti gli autori hanno completato il modulo di divulgazione uniforme dell’ICMJE su http://www.icmje.org/coi_disclosure.pdf (disponibile su richiesta dell’autore corrispondente) e dichiarano: questo studio fa parte di un dottorato di ricerca finanziato da Laura e John Arnold Foundation per l’autore principale (TS); nessun rapporto finanziario con organizzazioni che potrebbero avere un interesse per il lavoro presentato nei tre anni precedenti; nessun altro rapporto o attività che possa sembrare aver influenzato il lavoro presentato.
- Approvazione etica: non richiesta.
- Trasparenza: l’autore principale (TS) e il garante dello studio (PCG) affermano che il manoscritto è un resoconto onesto, accurato e trasparente dello studio riportato. Nessun aspetto importante dello studio è stato omesso. Nessuna discrepanza viene trattenuta.
- Condivisione dei dati: dati aggiuntivi e relazioni sugli studi clinici possono essere ottenuti dall’autore corrispondente su richiesta.
Questo è un articolo ad accesso aperto distribuito in conformità con la licenza Creative Commons Attribution Non Commercial (CC BY-NC 3.0), che consente ad altri di distribuire, remixare, adattare, costruire su questo lavoro in modo non commerciale e concedere in licenza i loro lavori derivati su diversi termini, a condizione che l’opera originale sia correttamente citata e l’uso non sia commerciale. Vedi: http://creativecommons.org/licenses/by-nc/3.0/
Riferimenti
- Fergusson D, Doucette S, Glass KC, et al. Association between suicide attempts and selective serotonin reuptake inhibitors: systematic review of randomised controlled trials. BMJ 2005;330: 396.
- Healy D. Let them eat Prozac.New York University Press, 2004.
- Teicher MH, Glod C, Cole JO. Emergence of intense suicidal preoccupation during fluoxetine treatment. Am J Psychiatry 1990;147: 207-10
- Gøtzsche PC. Deadly psychiatry and organised denial.People’s Press, 2015.
- Whittington CJ, Kendall T, Fonagy P, et al. Selective serotonin reuptake inhibitors in childhood depression: systematic review of published versus unpublished data. Lancet 2004;363: 1341-5.
- Healy D. Did regulators fail over selective serotonin reuptake inhibitors?BMJ 2006;333: 92-5.
- Laughren TP. Overview for December 13 meeting of Psychopharmacologic Drugs Advisory Committee (PDAC). 2006.
- Gunnell D, Saperia J, Ashby D. Selective serotonin reuptake inhibitors (SSRIs) and suicide in adults: meta-analysis of drug company data from placebo controlled, randomised controlled trials submitted to the MHRA’s safety review. BMJ 2005;330: 385
- Bond AJ. Antidepressant treatments and human aggression. Eur J Pharmacol 2005;526: 218-25.
- Bouvy PF, Liem M. Antidepressants and lethal violence in the Netherlands 1994-2008. Psychopharmacology (Berl) 2012;222: 499-506.
- Breggin PR. Fluvoxamine as a cause of stimulation, mania, and aggression: a critical analysis of the FDA-approved label. Ethical Hum Sci Serv 2002;4: 211-27.
- Breggin PR. Suicidality, violence and mania caused by selective serotonin reuptake inhibitors (SSRIs): a review and analysis. Int J Risk Saf Med 2003;16: 31-49.
- Krakowski M. Violence and serotonin: influence of impulse control, affect regulation, and social functioning. J Neuropsychiatry Clin Neurosci 2003;15: 294-305
- Lucire Y, Crotty C. Antidepressant-induced akathisia-related homicides associated with diminishing mutations in metabolizing genes of the CYP450 family. Pharmgenomics Pers Med 2011;4: 65-81.
- Walsh MT, Dinan TG. Selective serotonin reuptake inhibitors and violence: a review of the available evidence. Acta Psychiatr Scand 2001;104: 84-91.
- United Kingdom Committee on Safety of Medicines, CSM. report of the CSM Expert Working Group on the safety of selective serotonin reuptake inhibitor antidepressants. Medicines and Healthcare products Regulatory Agency; 2004.
- Moore TJ, Glenmullen J, Furberg CD. Prescription drugs associated with reports of violence towards others. PLoS One 2010;5: e15337.
- SSRI stories. SSRI stories: antidepressant nightmares. 2013.
- Adler LA, Angrist BM. Paroxetine and akathisia. Biol Psychiatry 1995;37: 336-7.
- Baldassano CF, Truman CJ, Nierenberg A, Ghaemi SN, Sachs GS. Akathisia: a review and case report following paroxetine treatment. Compr Psychiatry 1996;37: 122-4
- Bass A. Side effects: a prosecutor, a whistleblower, and a bestselling antidepressant on trial.Algonquin Books, 2008.
- Breggin P, Breggin GR. Talking back to Prozac: what doctors aren’t telling you about today’s most controversial drug.E-reads, 1994.
- Breggin P. Medication madness: the role of psychiatric drugs in cases of violence, suicide, and crime.St Martin’s Griffin, 2008.
- Healy D, Herxheimer A, Menkes DB. Antidepressants and violence: problems at the interface of medicine and law. PLoS Med 2006;3: e372.
- Miller M, Swanson SA, Azrael D, Pate V, Stürmer T. Antidepressant dose, age, and the risk of deliberate self-harm. JAMA Intern Med 2014;174: 899-909.
- Koliscak LP, Makela EH. Selective serotonin reuptake inhibitor-induced akathisia. J Am Pharm Assoc (2003) 2009;49: e28-36, quiz e37-8.
- Wieseler B, Wolfram N, McGauran N, et al. Completeness of reporting of patient-relevant clinical trial outcomes: comparison of unpublished clinical study reports with publicly available data. PLoS Med 2013;10:e1001526.
- Maund E, Tendal B, Hróbjartsson A, et al. Benefits and harms in clinical trials of duloxetine for treatment of major depressive disorder: comparison of clinical study reports, trial registries, and publications. BMJ 2014;348: g3510.
- Stone M, Laughren T, Jones ML, et al. Risk of suicidality in clinical trials of antidepressants in adults: analysis of proprietary data submitted to US Food and Drug Administration. BMJ 2009;339: b2880.
- Lilly E. Clinical Trial Report (CTR) summaries. 2014.
- Higgins JPT, Green S, eds. Cochrane handbook for systematic reviews of interventions version 5.1.0. Cochrane Collaboration, 2011.
- Sweeting MJ, Sutton AJ, Lambert PC. What to add to nothing? Use and avoidance of continuity corrections in meta-analysis of sparse data. Stat Med 2004;23: 1351-75.
- Structure and content of clinical study reports: E3. International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use, 1995.
- Chou R, Helfand M. Challenges in systematic reviews that assess treatment harms. Ann Intern Med 2005;142(12_Part_2):1090-9.
- Laughren TP. The scientific and ethical basis for placebo-controlled trials in depression and schizophrenia: an FDA perspective. Eur Psychiatry 2001;16: 418-23.
- Le Noury J, Nardo JM, Healy D, et al. Restoring Study 329: efficacy and harms of paroxetine and imipramine in treatment of major depression in adolescence. BMJ 2015;351: h4320.
- Bielefeldt AØ, Danborg PB, Gøtzsche PC. Systematic review of adverse effects of antidepressants in healthy volunteer studies. Proceedings of the 23rd Cochrane colloquium. Vienna, Austria; Cochrane 2015.
- Rosenbaum JF, Fava M, Hoog SL, Ascroft RC, Krebs WB. Selective serotonin reuptake inhibitor discontinuation syndrome: a randomized clinical trial. Biol Psychiatry 1998;44: 77-87.
- Vanderburg DG, Batzar E, Fogel I, Kremer CM. A pooled analysis of suicidality in double-blind, placebo-controlled studies of sertraline in adults. J Clin Psychiatry 2009;70: 674-83
- Furukawa TA. All clinical trials must be reported in detail and made publicly available. BMJ 2004;329: 626.
- Breggin PR. How GlaxoSmithKline suppressed data on Paxil-induced akathisia: implications for suicidality and violence. Ethical Hum Psychol Psychiatry 2006;8: 91-100.
- FDA. Antidepressant use in children, adolescents, and adults. 2014. www.fda.gov/downloads/Drugs/DrugSafety/InformationbyDrugClass/UCM173233.pdf.
- GlaxoSmithKline. Important prescribing information. Letter to healthcare professionals, May 2006. www.gsk.com/media/388699/adult_hcp_letter.pdf.
- Molero Y, Lichtenstein P, Zetterqvist J, Gumpert CH, Fazel S. Selective serotonin reuptake inhibitors and violent crime: a cohort study. PLoS Med 2015;12: e1001875.
- Gøtzsche PC, Young AH, Crace J. Does long term use of psychiatric drugs cause more harm than good?BMJ 2015;350: h2435.
- Leucht S, Fennema H, Engel R, Kaspers-Janssen M, Lepping P, Szegedi A. What does the HAMD mean?J Affect Disord 2013;148: 243-8.
- Moncrieff J, Wessely S, Hardy R. Active placebos versus antidepressants for depression. Cochrane Database Syst Rev 2004;1: CD003012.
- Larun L, Nordheim LV, Ekeland E, Hagen KB, Heian F. Exercise in prevention and treatment of anxiety and depression among children and young people. Cochrane Database Syst Rev 2006;3: CD004691.
- Cooney GM, Dwan K, Greig CA, et al. Exercise for depression. Cochrane Database Syst Rev 2013;9: CD004366.
- Cox GR, Callahan P, Churchill R, et al. Psychological therapies versus antidepressant medication, alone and in combination for depression in children and adolescents. Cochrane Database Syst Rev 2012;11: CD008324.
- Driessen E, Hollon SD, Bockting CL, Cuijpers P, Turner EH. Does Publication bias inflate the apparent Efficacy of psychological treatment for major depressive disorder? A systematic review and meta-analysis of US National Institutes of Health-funded trials. PLoS One 2015;10: e0137864
- Doshi P, Dickersin K, Healy D, Vedula SS, Jefferson T. Restoring invisible and abandoned trials: a call for people to publish the findings. BMJ 2013;346: f2865
- European Medicines Agency. Publication and access to clinical-trial data. 2014. www.ema.europa.eu/docs/en_GB/document_library/Other/2013/06/WC500144730.pdf.
- Cohen D. Rosiglitazone: what went wrong?BMJ 2010;341: c4848.